题目内容
下列能达到实验目的的是
B
解析

练习册系列答案
相关题目
高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。
相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)仪器e的名称为 ,装置A中f管的作用是 ,其中发生反应的离子方程式为 。
(2)装置B中的试剂是 。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
| 方案 | 不足之处 |
| 甲 | |
| 乙 | |
(4)在上述(3)的评价基础上,请设计一个合理方案: 。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
下列实验装置或操作正确的是 ( )

| A.实验① 制取氨气 |
| B.实验② 溴水褪色证明了乙烯可以与溴发生加成反应 |
| C.实验③ 比较红磷和白磷的着火点 |
| D.实验④ 用CaC2和饱和食盐水反应制取C2H2 |
用左下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中的试剂为丙,则下表中现象与结论均正确的是
| 选项 | 甲 | 乙 | 丙 | 试管中现象 | 结论 |
| A | 浓氨水 | 生石灰 | AgNO3溶液 | 无明显现象 | NH3与AgNO3溶液不反应 |
| B | 盐酸 | 碳酸钠 | BaCl2溶液 | 变浑浊 | 盐酸酸性强于碳酸 |
| C | 饱和食盐水 | 电石 | 酸性KMnO4溶液 | 紫色褪去 | 乙炔可被KMnO4氧化 |
| D | 浓硫酸 | 亚硫酸钠 | 溴水 | 橙色褪去 | SO2具有漂白性 |
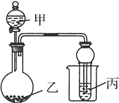
下述实验能达到预期目的的是
| A.甲图:验证铜与稀硝酸反应的气体产物只有NO |
| B.乙图:实验室制取乙酸乙酯 |
| C.丙图:验证钢铁片发生吸氧腐蚀 |
| D.丁图:证明在相同温度下Mg(OH)2的溶解度大于Fe(OH)3 |
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现 象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
某同学想利用实验证明高锰酸钾溶液的紫色是MnO4-的颜色,而不是K+的颜色,他设计的下列实验步骤中没有意义的是( )
| A.将高锰酸钾晶体加热分解,所得固体质量减小 |
| B.观察氯化钾溶液没有颜色,表明溶液中的K+无色 |
| C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应 |
| D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫色褪去,表明MnO4-为紫色 |
下列有关操作或说法不正确的是( )
| A.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| B.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| C.在硫酸镁溶液中加入氢氧化钠可以得到氢氧化镁沉淀 |
| D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
下列有关判断中不正确的是 ( )。
| A.溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B.若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| C.方案一可能产生氢气,方案二可能剩余铜 |
| D.实验室中方案Ⅱ更便于实施 |