题目内容
【题目】已知可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____。
CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和___(填化学式),由此可以推知CN22-的空间构型为___。
(2)尿素分子中C原子采取____杂化。尿素分子的结构简式是____。
(3)三聚氰胺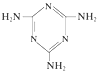 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸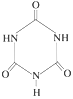 后,三聚氰酸与三聚氰胺分子相互之间通过____结合,在肾脏内易形成结石。
后,三聚氰酸与三聚氰胺分子相互之间通过____结合,在肾脏内易形成结石。
(4)H2与O2发生反应的过程用模型图示如下(“—”表示化学键):
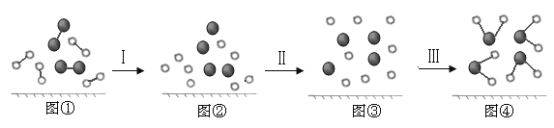
其中过程Ⅰ是___过程(填“吸热”、“放热”或“没有能量变化”)。图④中产生了由极性键构成的_______分子(填“极性”或“非极性”)。
(5)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_____。

已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离_____(列出计算式)CaO晶体和NaCl晶体的晶格能分别为:CaO3401kJ·mol-1、NaCl786kJ·mol-1。导致两者晶格能差异的主要原因是________。
【答案】1s22s22p63s23p63d104s2或[Ar]3d104s2 CO2 直线形 sp2 ![]() 分子间氢键 吸热 极性 6
分子间氢键 吸热 极性 6 ![]() ×
×![]() CaO晶体中的Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量
CaO晶体中的Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量
【解析】
(1)Ca位于第四周期、最外层电子数为2,最外层电子数为2、内层排满电子的第四周期元素原子是Zn,根据核外电子排布规律书写;根据等电子体的概念确定与CN22-互为等电子体的分子,根据二氧化碳的空间构型确定CN22-离子的空间构型;
(2)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式和分子空间结构;
(3)氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间;
(4)破坏化学键要吸收能量;根据水的结构判断分子的极性;
(5)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;根据均摊法计算晶胞的质量和体积,求出晶胞参数,晶胞中距离最近的两个钙离子之间的距离为体对角线的一半;晶格能大小与离子带电量成正比,与离子半径成反比。
(1)Ca位于第四周期、最外层电子数为2,最外层电子数为2、内层排满电子的第四周期元素原子是Zn,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;与CN22-互为等电子体的分子有N2O和CO2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形,故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线形;
(2)CO(NH2)2分子的中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形,碳原子采取sp2杂化,尿素分子的结构简式是![]() ,故答案为:sp2;
,故答案为:sp2;![]() ;
;
(3)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石,故答案为:分子间氢键;
(4)过程Ⅰ中破坏化学键要吸收能量;图④中产生了由极性键构成的水分子,水分子空间结构为V形,结构不对称,正负电荷中心不重叠,为极性分子,故答案为:吸热;极性;
(5)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6;把CaO晶胞看作有8个小立方体无隙并置而成,取![]() 立方体作为研究对象,利用均摊法计算出Ca 2+、O 2-的个数分别为:4×
立方体作为研究对象,利用均摊法计算出Ca 2+、O 2-的个数分别为:4×![]() =
=![]() ,即含
,即含 ![]() 个CaO,其质量为
个CaO,其质量为![]() ,设
,设![]() 立方体的边长为a,则其体积为a3,据公式ρ=
立方体的边长为a,则其体积为a3,据公式ρ=![]() 得:ρ×a3=
得:ρ×a3=![]() ,a=
,a=![]() ,从上图可以看出,处于正方形对角线的两个钙离子的间距最小,所以晶胞中距离最近的两个钙离子之间的距离d=
,从上图可以看出,处于正方形对角线的两个钙离子的间距最小,所以晶胞中距离最近的两个钙离子之间的距离d=![]() a=
a=![]() ×
×![]() ;晶格能大小与离子带电量成正比,CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,故答案为:6;
;晶格能大小与离子带电量成正比,CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,故答案为:6;![]() ×
×![]() ;CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量。
;CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量。