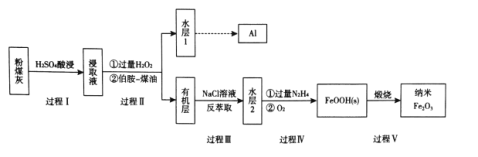
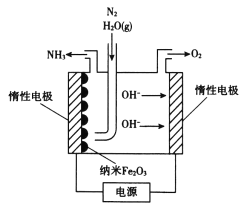
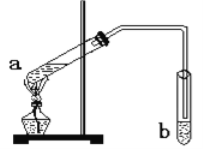
题目内容
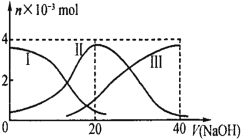
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如右图所示。据图分析,下列判断错误的是

A. Ksp[Fe(OH)3]< Ksp [Cu(OH)2]
B. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
【答案】C
【解析】
试题A、由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)(OH-)3=c(Fe3+)(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)(OH-)2=c(Cu2+)(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],A正确;B、b、c两点分别处在两条的沉淀溶解平衡曲线上,故两点均代表溶液达到饱和,B正确;C、向溶液中加入NH4Cl固体,不会导致溶液中的c(OH-)增大,故不能使溶液由a点变到b点,C错误;D、只要温度不发生改变,溶液中c(H+)与c(OH-)的乘积(即Kw)就不变。该题中温度条件不变,故c、d两点代表的溶液中c(H+)与c(OH-)的乘积相等,D正确,答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染的N2和CO2的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。