题目内容
下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
C
试题分析:A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),是因为难溶的向更难溶的转化。则Ksp(PbS)>Ksp(CuS)。错误。B.在NaHS溶液中,存在电离平衡:HS-
 H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,所以电离平衡正向移动,c(H+)增大,则pH减小。C.TiCl4是强酸弱碱盐,水解消耗水电离产生的OH-,产生Ti(OH)4.水解反应是吸热反应,所以加热条件下可促进TiCl4水解,产生更多的Ti(OH)4。然后过滤、洗涤Ti(OH)4,加热分解就可以制备TiO2固体。正确。D.铜制器皿放置过程中会生成铜绿是因为发生了反应:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。错误。
H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,所以电离平衡正向移动,c(H+)增大,则pH减小。C.TiCl4是强酸弱碱盐,水解消耗水电离产生的OH-,产生Ti(OH)4.水解反应是吸热反应,所以加热条件下可促进TiCl4水解,产生更多的Ti(OH)4。然后过滤、洗涤Ti(OH)4,加热分解就可以制备TiO2固体。正确。D.铜制器皿放置过程中会生成铜绿是因为发生了反应:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。错误。
练习册系列答案
相关题目
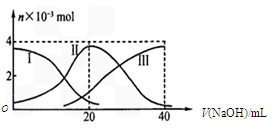
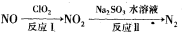
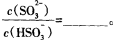 。
。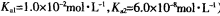 )
)
 ___pH
___pH 。(填
。(填