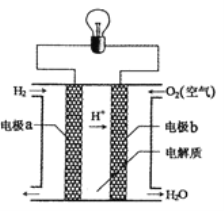
题目内容
【题目】下表列出了①~⑤五种元素在周期表中的位置:
ⅠA | O | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ||||||
请回答下列问题:
(1)写出以上五种元素对应的元素符号_______、_______、_______、_______、_______;
(2)②和③元素所形成的气态氢化物的稳定性由强到弱的顺序是(________)
A.前者大 B.后者大 C.相等 D.无法比较
(3)②元素的最高价氧化物的水化物呈(填“酸”、“碱”、“中”)_______性;
(4)②③两种元素的原子半径由大到小的顺序是(用元素符号表示)_______;
A.前者大 B.后者大 C.相等 D.无法比较
(5)①与⑤两种元素形成的化合物的化学式是_______;
(6)②与④两种元素的最高价氧化物的水化物在溶液中相互反应的化学方程式是____;
(7)写出①的氧化物含有的化学键类型_______,写出⑤的原子结构示意图_______;
(8)写出元素③处于第_______周期,第_______族;
(9)写出实验室制取⑤的单质的化学反应方程式_______;实验结束时,尾气处理应选择的试剂是_______溶液(化学式或名称);
(10)周期表中,同一主族从上往下原子半径_______,_______递增;周期表中,同一周期从左向右原子半径_______,_______递增。
【答案】H N O Na Cl B 酸 A HCl NaOH+HNO3=NaNO3+H2O 极性键 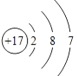 二 ⅥA MnO2+4HCl(浓)
二 ⅥA MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 氢氧化钠 递增 金属性 递减 非金属性
MnCl2+Cl2↑+2H2O 氢氧化钠 递增 金属性 递减 非金属性
【解析】
根据元素在周期表中的相对位置首先判断出元素名称,然后结合元素周期律以及有关物质的性质分析解答。
根据元素在周期表中的相对位置可知①~⑤五种元素分别是H、N、O、Na、Cl。则
(1)以上五种元素对应的元素符号分别是H、N、O、Na、Cl;
(2)同周期自左向右非金属性逐渐增强,非金属性越强,氢化物越稳定,则②和③元素所形成的简单氢化物的稳定性由强到弱的顺序是O>N,即后者大,答案选B。
(3)②元素是氮元素,其最高价氧化物的水化物是硝酸,溶液呈酸性;
(4)同周期自左向右原子半径逐渐减小,则②③两种元素的原子半径由大到小的顺序是N>O,即前者大,答案选A。
(5)①与⑤两种元素形成的化合物是氯化氢,化学式是HCl;
(6)②与④两种元素的最高价氧化物的水化物分别是硝酸和氢氧化钠,在溶液中相互反应的化学方程式是NaOH+HNO3=NaNO3+H2O;
(7)①的氧化物是水,其中含有的化学键类型是极性键,⑤是氯元素,其原子结构示意图为 ;
;
(8)元素③是氧元素,处于第二周期第ⅥA族;
(9)实验室制取氯气的化学反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;氯气有毒,能与氢氧化钠溶液反应,实验结束时,尾气处理应选择的试剂是氢氧化钠溶液;
MnCl2+Cl2↑+2H2O;氯气有毒,能与氢氧化钠溶液反应,实验结束时,尾气处理应选择的试剂是氢氧化钠溶液;
(10)周期表中,同一主族从上往下原子半径逐渐递增,金属性递增;周期表中,同一周期从左向右原子半径递减,非金属性递增。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】在1—18号元素中,选择合适的选项回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
【1】写出①和②的非金属性较强的是( )
A. 前者大B. 后者大C. 相等D. 无法比较
【2】写出④的最高价氧化物化学式( )
A. ROB. R2OC. R2O3D. RO2
【3】写出③和⑤的最高价氧化物对应水化物反应的离子方程式( )
A. 2NaOH+H2SO4=Na2SO
C. NaOH+H2SO4=Na2SO4+H2OD. 2OH- +H2SO4=SO42- +2H2O
【4】③和④两种元素的最高价氧化物对应水化物中碱性较强的是
A. 前者大B. 后者大C. 相等D. 无法比较
【5】写出③的单质在②单质中燃烧的现象()
A. 白色固体B. 淡黄色固体C. 浅紫色火焰D. 苍白色火焰
【6】①元素在周期表中的位置是( )
A. 第二周期第四主族B. 第二周期第IV主族
C. 第二周期第IVA族D. 第二周期第VA族
【7】②和⑤两种元素中原子半径较大的是( )
A. 前者大B. 后者大C. 相等D. 无法比较
【8】下列化学用语表达不正确的是( )
A. 氟离子的结构示意图: ![]() B. 水分子的电子式:
B. 水分子的电子式:![]()
C. 二氧化碳的结构式:O=C=OD. 硫酸钠的电离方程式:Na2SO4=2Na++SO42-
【9】⑤和⑥形成的气态氢化物最稳定的是( )
A. 前者大B. 后者大C. 相等D. 无法比较
【10】④的氧化物类型为 ( )
A. 酸性氧化物,非金属氧化物B. 两性氧化物,金属氧化物
C. 碱性氧化物,金属氧化物D. 酸性氧化物,金属氧化物