题目内容
【题目】用未知浓度NaOH溶液滴定标准醋酸溶液,其pH变化曲线如图,则下列说法正确的是( )
A.醋酸溶液浓度为![]()
B.滴定过程中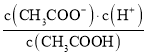 逐渐减小
逐渐减小
C.a、b、c三点溶液的导电能力逐渐减小
D.C点处溶液中![]()
【答案】D
【解析】
A.醋酸为弱电解质,在溶液中只能部分电离出氢离子;
B.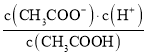 为醋酸的电离平衡常数;
为醋酸的电离平衡常数;
C.溶液导电性与离子浓度大小有关,a为醋酸溶液,溶液中离子浓度最小,之后随着氢氧化钠的滴入,离子浓度逐渐增大;
D.c点溶液的![]() ,呈中性,结合电荷守恒分析。
,呈中性,结合电荷守恒分析。
![]() 根据图象可知,该醋酸溶液的
根据图象可知,该醋酸溶液的![]() ,氢离子浓度为
,氢离子浓度为![]() ,由于醋酸部分电离,则醋酸溶液浓度大于
,由于醋酸部分电离,则醋酸溶液浓度大于![]() ,故A错误;
,故A错误;
B.滴定过程中温度不变,则醋酸的电离平衡常数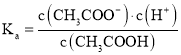 的值不变,故B错误;
的值不变,故B错误;
C.a点为醋酸溶液,溶液中离子浓度较小,导电性最弱,随着滴入NaOH溶液,溶液中离子浓度逐渐增大,导电性逐渐增强,故C错误;
D.c点![]() ,则
,则![]() ,根据电荷守恒可知:
,根据电荷守恒可知:![]() ,故D正确;
,故D正确;
故选:D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目