题目内容
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素符号:① _________,⑥_________,⑦_______。
(2)画出原子的结构示意图:④__________,⑧____________。
(3)在①~12元素中,金属性最强的元素是______,非金属性最强的元素是____,最不活泼的元素是_____。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是___(填序号),跟它同周期原子半径最小的元素是__(填序号),它们可以形成____(填离子或共价)化合物,用电子式表示其形成过程:____。(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:_____
【答案】N Si S ![]()
 K F Ar Cl b ③ ⑧ 离子
K F Ar Cl b ③ ⑧ 离子 ![]()
![]()
【解析】
根据元素所在周期表中的位置,可知元素的种类,①为N元素,②为F元素,③为Na元素,④为Mg元素,⑤为Al元素,⑥为Si元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,
⑩为K元素,⑾为Ca元素,⑿为Br元素,据此答题。
(1)根据元素周期表的结构可知:①、⑥、⑦分别在第二周期VA、第三周期IIA和第三周期VIA,则①、⑥、⑦分别为N、Si、S,故答案为:N、Si、S。
(2)根据元素周期表可判断,④、⑧分别是Mg和Cl,Mg和Cl均有3个电子层,最外层电子数分别为2、7,根据核外电子排布规律,Mg和Cl的原子结构示意图分别为![]() ;
;![]() ,故答案为:
,故答案为:![]() ,
,![]() 。
。
(3)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na(③)和K(⑩)中K最活泼;在VII元素Cl(⑧)和Br中,Cl最活泼;最不活泼的是⑨即Ar,故答案为:K;F;Ar。
(4)⑦和⑧分别是S和Cl,根据同周期元素非金属性的递变规律可知,非金属性Cl>S, a.常温下单质的状态属于物理性质,不能用以判断非金属性的强弱,故a错误;
b.⑧的氢化物比⑧的氢化物稳定,说明⑧的非金属性较强,故b正确;
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应,说明都具有氧化性,但不能说明非金属性的强弱,故c错误;
故答案为:Cl,b。
(5)同周期自左而右原子半径减小,故第三周期中③Na原子半径最大,⑧Cl原子半径最小,二者形成的化合物为NaCl,属于离子化合物,由钠离子与氯离子构成,用Na原子、Cl原子的电子式表示其形成为:![]() ,故答案为:③;⑧;离子;
,故答案为:③;⑧;离子;![]() 。
。
(6)某元素原子最外层电子数是其次外层电子数的2倍,该元素为C,与⑧形成一种AB4型的化合物为CCl4,其形成过程为![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
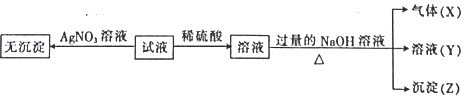
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。


