题目内容
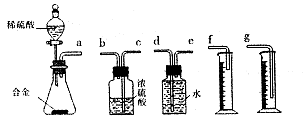
铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)请用离子方程式表示以上工艺流程中第①步反应:_______ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:______ ___________。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途________________。
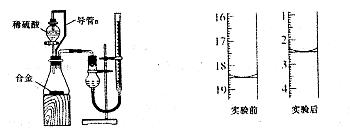
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是________________。

(1)请用离子方程式表示以上工艺流程中第①步反应:_______ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:______ ___________。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途________________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是________________。
(1)Al2O3+2OH-=2AlO2-+H2O
(2)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(3)2Al+Fe2O3 2Fe+Al2O3: 焊接铁轨
2Fe+Al2O3: 焊接铁轨
(4)8.1g
(2)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(3)2Al+Fe2O3
 2Fe+Al2O3: 焊接铁轨
2Fe+Al2O3: 焊接铁轨(4)8.1g
试题分析:(1)因题目已经给出了铝土矿的主要成分是Al2O3,所以第一步反应中与NaOH溶液反应的是Al2O3,Al2O3+2OH-=2AlO2-+H2O
(2)结合实验室制取Al(OH)3的原理,我们可以写出反应方程式NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(3)铝热反应方程式:2Al+Fe2O3=2Fe+Al2O3。
(4)
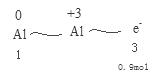
所以可以推出反应的铝为0.3mol,质量为0.3mol*27g/mol=8.1g

练习册系列答案
相关题目
 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
 操作正确且能达到目的的是
操作正确且能达到目的的是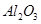 ,含
,含 、
、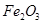 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: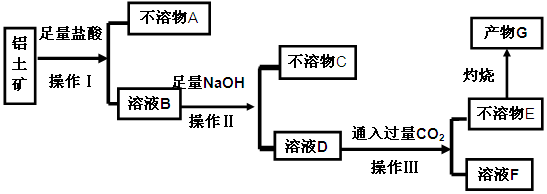
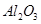 ,含
,含 、
、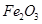 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下: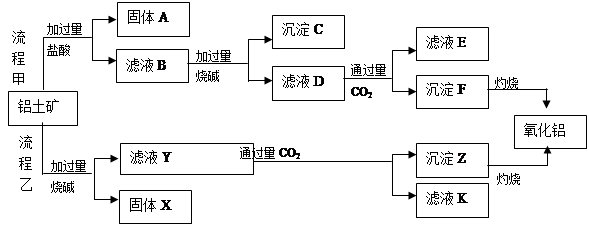
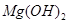 的溶度积常数
的溶度积常数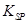 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______. 。
。
 。
。