题目内容
水杨酸甲酯(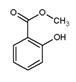 )具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸(
)具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸(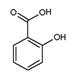 )与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )
)与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )
| A.NaHCO3溶液 | B.NaOH溶液 | C.Na2CO3溶液 | D.NaCl溶液 |
A
解析试题分析:因NaHCO3溶液与苯酚不反应,所以不与水杨酸甲酯中酚羟基反应,但水杨酸有羧基可以和NaHCO3溶液反应,从而起到除杂的作用。而NaOH和Na2CO3溶液 与水杨酸甲酯反应,不能用来除杂。选A。
考点:考查物质分离与提纯等相关知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为提纯下列物质(括号中为杂质),所选除杂试剂和分离的主要操作方法都合理的是
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 主要操作方法 |
| A | NaHCO3溶液(Na2CO3) | 澄清石灰水 | 过滤 |
| B | NaCl溶液(Br2) | 乙醇 | 分液 |
| C | CO2(SO2) | 饱和NaHCO3溶液 | 洗气 |
| D | KNO3溶液(KOH) | FeCl3溶液 | 过滤 |
不用其他试剂无法鉴别的一组溶液是
| A.氯化铁溶液和氯化铜溶液 |
| B.硫酸钠溶液和氯化钠溶液 |
| C.氯化铝溶液和氢氧化钠溶液 |
| D.硫酸溶液和碳酸钠溶液 |
要从苯酚的乙醇溶液中回收苯酚,有下列操作;①蒸馏;②过滤;③静置分液;④加入足量金属钠;⑤通入过量CO2;⑥加入足量NaOH溶液;⑦加入足量FeCl3溶液;⑧加入乙酸与浓H2SO4混合加热,合理的步骤是
| A.④⑤③ | B.⑥①⑤③ | C.⑧① | D.⑧②⑤③ |
下列实验设计能够成功的是
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 |  |
| B | 检验某卤代烃是否是氯代烃 |  |
| C | 证明酸性条件H2O2氧化性比I2强 |  |
| D | 除去铁屑表面的油污 | 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净 |
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴化钠溶液(NaI) | 氯水,CCl4 | 萃取、分液 |
| B | 苯(苯酚) | NaOH溶液 | 过滤 |
| C | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| D | 乙醇(乙酸) | 新制生石灰(CaO) | 蒸馏 |
下列有关物质检验的实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体水溶液一定显碱性 |
| D | 将少量某有机物滴加到新制氢氧化铜悬浊液中,充分振荡,未见红色沉淀生成 | 该有机物不含醛基 |
(16分)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为: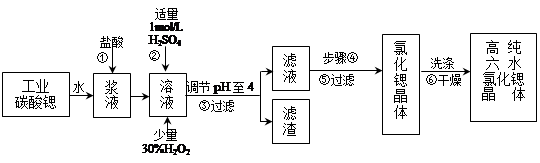
已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
下列除去杂质的方法,正确的是
| A.苯中含有苯酚杂质:加入溴水,过滤 |
| B.乙醇中含有乙酸杂质:加入碳酸钠溶液,分液 |
| C.FeCl3溶液中含有CuCl2杂质:加入过量铁粉,过滤 |
| D.CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |