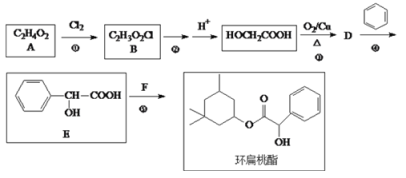
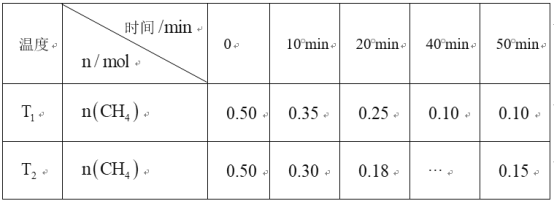
题目内容
【题目】X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子具有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为______。
(2)Z2Y对应水化物的碱性比LiOH的_____(填“强”或“弱”),Z2Y对应水化物的电子式为________________
(3)Z2X属于_____(填“共价”或“离子”)化合物,用电子式表示Z2X的形成过程________________
(4)Z2Y2含有_____键和______键,电子式为___________________,Z2Y2溶于水时发生反应的化学方程式是____________。
【答案】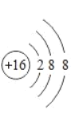 强
强 ![]() 离子
离子 ![]() 离子 非极性共价
离子 非极性共价 ![]() 2Na2O2+2H2O==4NaOH+O2↑
2Na2O2+2H2O==4NaOH+O2↑
【解析】
根据已知条件分析,Y和Z可以形成Z2Y和Z2Y2两种化合物,且Y和Z的离子具有形同的电子层结构,故可推出Y为O元素,Z为Na元素;X和Y可以形成XY2和XY3两种化合物,且X离子比Y离子多1个电子层,可以推出X为S元素,据此答题。
(1)X为S元素,则S2-的离子结构示意图为 ;
;
(2)Z2Y对应的水化物为NaOH,其碱性比LiOH强,因为Na的非金属性比Li强;NaOH的电子式为![]() ;
;
(3)Z2X为Na2S,为离子化合物,用电子式表示Na2S的形成过程为
![]() ;
;
(4)Z2Y2为Na2O2,结构中含有离子键和非极性共价键,其电子式为![]() ;Na2O2与水发生反应生成氧气和氢氧化钠,化学方程式为2Na2O2+2H2O==4NaOH+O2↑。
;Na2O2与水发生反应生成氧气和氢氧化钠,化学方程式为2Na2O2+2H2O==4NaOH+O2↑。

练习册系列答案
相关题目