题目内容
【题目】(1)固体可分为晶体、非晶体和准晶体三大类,可通过________________方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。基态Mn原子的电子排布式为_______________。
(2)PCl3的立体构型为______________,中心原子的杂化轨道类型_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3 | BCl3 | BBr3 | BI3 | |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是___________________。
②B、C、N、O三种元素第一电离能由小到大的顺序为___________。
③用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:____________。
(4)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
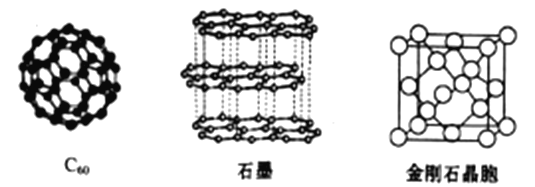
回答下列问题
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm,其原因是金刚石中只存在C-C间的________共价键,而石墨层内的C-C间存在_________键。
②金刚石晶胞含有___________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,列式表示碳原子在晶胞中的空间占有率__________(不要求计算结果)。
【答案】 X-射线衍射 [Ar]3d54s2 三角锥形 sp3 分子结构相似,相对分子质量增大,分子间作用力逐渐增强 B<C<O<N BF3分子中硼原子有空轨道,F-有孤对电子,能通过配位键形成BF4- σ σ、π 8 ![]()
【解析】(1)固体可分为晶体、非晶体和准晶体三大类,可通过X-射线衍射方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。锰是25号元素,基态Mn原子的电子排布式为[Ar]3d54s2,故答案为:X-射线衍射; [Ar]3d54s2;
(2)PCl3中P原子与3个氯原子相连,含有1个孤电子对,立体构型为三角锥形,中心原子的杂化轨道类型为sp3杂化,故答案为:三角锥形;sp3;
(3)①硼的四种卤化物均为分子晶体,且分子结构相似,相对分子质量逐渐增大,分子间作用力逐渐增强,沸点依次升高,故答案为:分子结构相似,相对分子质量增大,分子间作用力逐渐增强;
②同一周期,从左到右,元素的第一电离能逐渐增大,但N原子的2p为半充满结构,均为稳定,第一电离能最大,B、C、N、O三种元素第一电离能由小到大的顺序为B<C<O<N,故答案为:B<C<O<N;
③BF3分子中硼原子有空轨道,F-有孤对电子,能通过配位键形成BF4-,因此反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生,故答案为:BF3分子中硼原子有空轨道,F-有孤对电子,能通过配位键形成BF4-;
(4)①金刚石中碳原子以sp3杂化,形成四条杂化轨道,全部形成σ键;石墨中碳原子以sp2杂化,形成三条杂化轨道,还有一条为杂化的p轨道,三条杂化轨道形成σ键,而未杂化p轨道形成π键,故答案为:σ;σ;π;
②晶胞中顶点微粒数为:8×![]() =1,面心微粒数为:6×
=1,面心微粒数为:6×![]() =3,体内微粒数为4,共含有8个碳原子;晶胞内含有四个碳原子,则晶胞体对角线长度与四个碳原子直径相同,即
=3,体内微粒数为4,共含有8个碳原子;晶胞内含有四个碳原子,则晶胞体对角线长度与四个碳原子直径相同,即![]() a=8r,r=
a=8r,r=![]() a;碳原子的体积为:8×
a;碳原子的体积为:8×![]() ×π×r3,晶胞体积为:a3,碳原子的空间利用率为:
×π×r3,晶胞体积为:a3,碳原子的空间利用率为:![]() =
=![]() =
=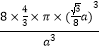 =
=![]() ,故答案为:8;
,故答案为:8;![]() 。
。