题目内容
氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是 。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式 。
(4)甲与乙之间能发生反应产生H2,判断理由是 。
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是 。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式 。
(4)甲与乙之间能发生反应产生H2,判断理由是 。
(1)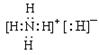
(2)4AlH3+3CO2 3CH4+2Al2O3
3CH4+2Al2O3
(3)2NH4H+5CuO 5Cu+ N2↑+5H2O
5Cu+ N2↑+5H2O
(4)AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。
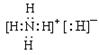
(2)4AlH3+3CO2
 3CH4+2Al2O3
3CH4+2Al2O3(3)2NH4H+5CuO
 5Cu+ N2↑+5H2O
5Cu+ N2↑+5H2O(4)AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。
试题分析:“单质气体丙在标准状态下的密度为1.25 g/L”则丙的相对分子质量=1.25×22.4=28,所以丙为N2。化合物乙分解得到H2和N2,由于乙是固体,所以化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物。6.00 g化合物甲分解得到短周期元素的金属单质和6.72L÷22.4L/mol=0.3 molH2。根据质量守恒定律可知,该短周期元素的金属单质的质量为6.00g-0.2mol×2g/mol=5.40g;化合物甲与水反应生成的白色沉淀可溶于NaOH溶液,说明该沉淀可能是Al(OH)3,因此该金属元素是铝,所以可判定化合物甲为AlH3。涉及的反应为:a.甲、乙受热分解:2AlH3
 2Al+3H2↑ 2NH4H
2Al+3H2↑ 2NH4H N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO
N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO 5Cu+ N2↑+5H2O。
5Cu+ N2↑+5H2O。(1)化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物,其电子式为
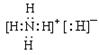 。
。(2)AlH3可在加热时将二氧化碳还原为甲烷,则根据原子守恒可知,另外一种生成物应该是氧化铝,所以其化学方程式是4AlH3+3CO2
 3CH4+2Al2O3。
3CH4+2Al2O3。(3)NH4H在加热条件下与CuO反应可生成Cu和气体单质氮气,因此根据原子守恒可知,还有水生成,所以该反应的化学方程式 2NH4H+5CuO
 5Cu+ N2↑+5H2O。
5Cu+ N2↑+5H2O。(4)由于AlH3中氢元素的化合价为-1价,—1价H还原性很强,NH4H中含有+1价的氢元素,具有氧化性,所以二者可发生氧化还原反应产生H2。

练习册系列答案
相关题目
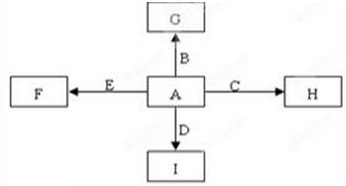
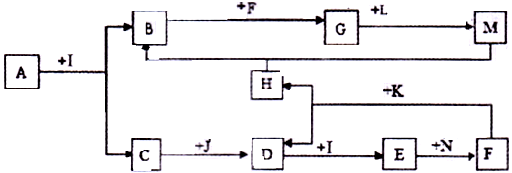
 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接; 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题: 、
、 可发生如下转化。
可发生如下转化。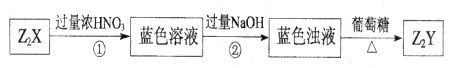
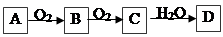
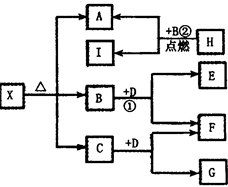

 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑