题目内容
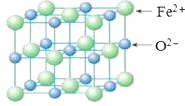
【题目】下列物质中含有共价键的离子化合物是( )
A. CO2 B. NaCl C. Na2O2 D. CH4
【答案】C
【解析】活泼的金属和非金属之间易形成离子键,非金属之间易形成共价键,含有离子键的化合价是离子化合物。A项,二氧化碳中碳原子和氧原子之间只存在共价键,是共价化合物,A错误;B项,氯化钠中只存在离子键,是离子化合物,B错误;C项,Na2O2中Na+和O22-之间是离子键,属于离子化合物,O原子和O原子之间存在共价键,C正确;D项,甲烷中碳原子和氢原子之间只存在共价键,是共价化合物,D错误。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
【实验一】配制并标定醋酸溶液的浓度。取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,然后用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所稀释的醋酸溶液的浓度进行标定。请回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液 的体积(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
则①滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂 D.甲基橙)为指示剂(填字母)
②该醋酸溶液的准确浓度为________(保留小数点后四位)。
【实验二】探究浓度对醋酸电离程度的影响。用pH计测定25 ℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸浓度 (mol·L-1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度______(填“增大”“减小”或“不变”)。
【实验三】探究温度对醋酸电离程度的影响。
(5)要完成该探究,需要用pH计(或pH试纸)测定 ___________________________。
【醋酸电离的应用】
(6)通过实验测定常温下醋酸的Ka=1×10-5,则0.1 mol·L-1醋酸钠溶液的pH=________。