题目内容
8.下列实验操作、实验现象及所得出的结论均正确的是( )| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色退去 | 2min后,出现凝胶 | 酸性:HCl>H2SiO3 |
| B | 在SiO2中加入蒸馏水,振荡 | SiO2溶解 | SiO2是H2SiO3的酸酐 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁与浓硫酸不反应 |
| D | 向某溶液中先滴加少量氯水,一会儿后滴加KSCN溶液 | 滴加氯水时无明显现象,滴加KSCN溶液后,混合液变成红色 | 原溶液中含有Fe2+,没有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.出现的凝胶为硅酸,说明盐酸的酸性大于硅酸;
B.二氧化硅不难溶于水;
C.常温下铁与浓硫酸发生钝化现象,不是不反应;
D.加入试剂顺序错误,应该先加入硫氰化钾溶液,再加入氯水.
解答 解:A..硅酸钠水解呈碱性,滴加酚酞变红色,向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,试管里出现凝胶,说明生成硅酸,则酸性:HCl>H2SiO3,故A正确;
B.在SiO2中加入蒸馏水,振荡,SiO2不溶解,故B错误;
C.由于铁与浓硫酸在常温下发生钝化,阻止了反应的继续进行,导致铁片不溶解,不是不反应,故C错误;
D.可能原溶液中只含有Fe3+,无法确定是否含有Fe2+,应该先滴加KSCN溶液,溶液无明显现象,再加入氯水,若混合液变成红色,说明原溶液中含有Fe2+,没有Fe3+,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大,注意元素化合物知识与实验的结合.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
19.下列反应的离子方程式书写正确的是( )
| A. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| B. | 实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH- | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++H2O2═2Mn2++3O2↑+4H2O |
16. 室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )
室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )
 室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )
室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )| A. | 随着盐酸加入,溶液中水的电离程度逐渐增大 | |
| B. | 随着盐酸加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | M 点,n(H+)-n(OH-)=(a×10-4-0.01)mol | |
| D. | 当 V(盐酸)=200mL时,c(CH3COO-)+c(CH3COOH)>c(Cl-) |
3.已知S和Cl两种元素均位于第三周期,则( )
| A. | 原子半径:S<Cl | |
| B. | 元素非金属性:S>Cl | |
| C. | 氢化物的稳定性:H2S>HCl | |
| D. | 最高价氧化物对应水化物的酸性:H2SO4<HClO4 |
13.下列属于烯烃的是( )
| A. | CH3CH2CH3 | B. | CH2=CHCH3 | C. | CH2=CHCH2Cl | D. | CH2=CHCOOH |
20.下列说法错误的是( )
| A. | 通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐 | |
| B. | 若按交叉分类法分类,碳酸钠既属于钠盐,又属于碳酸盐 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
17.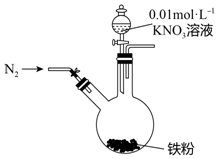 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
(1)通入N2并保持后续反应均在N2氛围中进行的实验目的是防止空气中的O2对Fe和NO3-反应的干扰,避免影响反应产物的判断.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)为了探宄滤液的成分,该同学进一步设计了下述实验:
(i)根据以上实验现象,可以判断滤液中存在NH4+、Fe2+、NO3-离子.
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:| 实验步骤 | 实验现象 |
| 1.打开弹簧夹,缓慢通入N2 | |
| 2.加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着. |
| 3.反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化. |
| 4将剩余固体过滤 | 表面的白色物质变为红褐色. |
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)为了探宄滤液的成分,该同学进一步设计了下述实验:
| 实验步骤 | 实验现象 |
| 1.取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
| 2.将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
| 3.另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸. | 有气体生成,该气体使红色石蕊试纸变蓝. |
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
