题目内容
18.从能量角度看,断开化学键要吸收热量,一个化学反应是释放能量还是吸收能量取决于反应物和生成物所具有的总能量的相对大小;在化学反应中,浓度越大,化学反应速率越快;温度越低化学反应速率越慢;使用催化剂可以使反应速率加快.分析 化学反应中断开化学键要吸收能量,形成化学键要放出能量,反应物与生成物的总能量大小决定反应热,一般来说,增大浓度、升高温度、加入催化剂等,可增大反应速率,以此解答该题.
解答 解:从能量角度看,断开化学键要吸收热量,一个化学反应是释放能量还是吸收能量取决于反应物和生成物所具有的总能量的相对大小;在化学反应中,浓度越大,化学反应速率越快;温度越低化学反应速率越慢;使用催化剂可以使反应速率加快,
故答案为:吸收; 反应物和生成物所具有的总能量的相对大小; 大; 慢;加快.
点评 本题考查化学反应与能量变化以及反应速率的影响因素,为高频考点,侧重考查学生的分析能力以及双基知识的掌握,难度不大.

练习册系列答案
相关题目
8.下列实验操作、实验现象及所得出的结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色退去 | 2min后,出现凝胶 | 酸性:HCl>H2SiO3 |
| B | 在SiO2中加入蒸馏水,振荡 | SiO2溶解 | SiO2是H2SiO3的酸酐 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁与浓硫酸不反应 |
| D | 向某溶液中先滴加少量氯水,一会儿后滴加KSCN溶液 | 滴加氯水时无明显现象,滴加KSCN溶液后,混合液变成红色 | 原溶液中含有Fe2+,没有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
9.下列实验现象预测正确的是( )
| A. |  实验:振荡后静置,上层溶液颜色保持不变 | |
| B. |  实验:试管溶液中出现气泡,溶液先出现浑浊后变澄清 | |
| C. |  实验:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 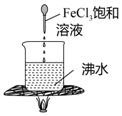 实验:加热至混合液呈红褐色,停止加热,该分散系能产生丁达尔效应 |
13.下列关于乙烯和苯的叙述中,错误的是( )
| A. | 乙烯能发生加聚反应 | B. | 乙烯可以燃烧 | ||
| C. | 苯能使酸性高锰酸钾溶液褪色 | D. | 苯分子中6个碳碳化学键完全相同 |
7. 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O2-8+2I-═2SO2-4+I2(慢)
I2+2S2O2-3═2I-+S4O2-6(快)
(1)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx=2mL,理由是理由是保证反应物K2S2O8浓度改变,而其他的不变,才到达实验目的.
(2)已知某条件下,浓度c(S2O2-8)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O2-8)~t的变化曲线示意图(进行相应的标注).
(3)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的S2O32-或Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O2-3与S2O2-8初始的物质的量需满足的关系为:n(S2O2-3):n(S2O2-8)<2:1.
(4)碘也可用作心脏起搏器电源--锂碘电池的材料.
该电池反应为:2Li(s)+I2(s)═2LiI(s)△H
已知:
4Li(s)+O2(g)═2Li2O(s)△H1
4LiI(s)+O2(g)═2I2 (s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{1}}{2}$;碘电极作为该电池的正极.
 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O2-8+2I-═2SO2-4+I2(慢)
I2+2S2O2-3═2I-+S4O2-6(快)
(1)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(2)已知某条件下,浓度c(S2O2-8)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O2-8)~t的变化曲线示意图(进行相应的标注).
(3)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的S2O32-或Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O2-3与S2O2-8初始的物质的量需满足的关系为:n(S2O2-3):n(S2O2-8)<2:1.
(4)碘也可用作心脏起搏器电源--锂碘电池的材料.
该电池反应为:2Li(s)+I2(s)═2LiI(s)△H
已知:
4Li(s)+O2(g)═2Li2O(s)△H1
4LiI(s)+O2(g)═2I2 (s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{1}}{2}$;碘电极作为该电池的正极.
9.1868年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一.下列有关元素周期表的说法不正确的是( )
| A. | 迄今人类发现的元素中,金属元素和非金属元素种数相近 | |
| B. | 元素周期表有18个纵行16个族,分为主族、副族、第Ⅷ族和零族 | |
| C. | 元素周期表有七个周期,分为短周期和长周期 | |
| D. | 人们在周期表中金属与非金属的分界处可以找到半导体材料,如硅、锗等 |
 现有A、B、C、D、E五种短周期非金属元素,其原子序数依次增大.A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等.C、E是同主族元素,它们的核外均有3个未成对电子.请回答下列问题:
现有A、B、C、D、E五种短周期非金属元素,其原子序数依次增大.A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等.C、E是同主族元素,它们的核外均有3个未成对电子.请回答下列问题:
 ;A 分子中能够共平面的原子 最多为8个,写出A与溴的四氯化碳反应的化学方程式
;A 分子中能够共平面的原子 最多为8个,写出A与溴的四氯化碳反应的化学方程式 .
.