题目内容
【题目】某同学利用所学知识探究Na2O2与H2能否反应,设计了如下装置图,回答下列问题:
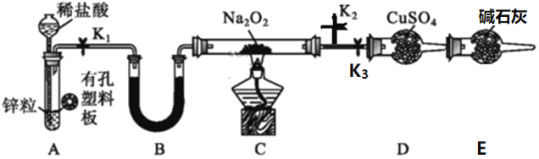
(1)装置A的气密性的检查方法是_______;A中发生反应的离子方程式为____________。
(2)Na2O2的电子式为_______________。装置中装硫酸铜固体的仪器名称是__________。装置B中盛放的试剂名称为__________。
(3)装置E的作用是_____________。
(4)实验中涉及到下列操作,其正确的顺序是____________。
①关闭K2,打开K1、K3,点燃C处酒精灯 ②在K2出口处收集一小试管气体验纯
③关闭K3,打开K1、K2 ④装置冷却后关闭K1 ⑤熄灭C处酒精灯
(5)若观察到D处干燥管中固体变蓝,则C中发生反应的化学方程式为_______。
【答案】关闭K1,从长颈漏斗口注水至漏斗中液面高于试管中液面,静置,观察,若内外液面高度差保持不变,则A装置气密性良好 Zn+2H+==Zn2++H2↑ ![]() 干燥管 碱石灰或生石灰 防止空气中水蒸气进入D中,对实验结果造成干扰 ③②①⑤④ Na2O2+H2
干燥管 碱石灰或生石灰 防止空气中水蒸气进入D中,对实验结果造成干扰 ③②①⑤④ Na2O2+H2 ![]() Na2O +H2O(g)
Na2O +H2O(g)
【解析】
首先进行装置气密性的检查;当装置气密性良好后,打开关闭K2,打开K1、K3,点燃C处酒精灯开始实验;锌与盐酸反应产生的氢气中含有氯化氢,影响实验的进行,因此需除去氯化氢,装置B中盛放碱石灰;纯净干燥的氢气与过氧化钠在C中加热反应,生成的气体通过硫酸铜固体,固体变蓝,说明反应产生了水,根据氧化还原反应规律可知,过氧化钠被还原为氧化钠;为防止空气中的水蒸气进入D中影响水的检验,所以还需在D后连接一个装有碱石灰的装置,吸收空气中的水蒸气;据以上分析进行解答。
(1)装置A的气密性的检查方法是:关闭K1,从长颈漏斗口注水至漏斗中液面高于试管中液面,静置,观察,若内外液面高度差保持不变,则A装置气密性良好;A中为锌粒与盐酸反应产生氢气,反应的离子方程式为:Zn+2H+==Zn2++H2↑;
故答案是:关闭K1,从长颈漏斗口注水至漏斗中液面高于试管中液面,静置,观察,若内外液面高度差保持不变,则A装置气密性良好;Zn+2H+==Zn2++H2↑;
(2)Na2O2属于离子化合物,电子式为![]() ;装置中装硫酸铜固体的仪器名称是球形干燥管;本实验目的是探究Na2O2与H2反应,所以氢气必须纯净,因此需要除去挥发出的氯化氢气体,因此装置B中盛放的试剂为碱石灰或生石灰;
;装置中装硫酸铜固体的仪器名称是球形干燥管;本实验目的是探究Na2O2与H2反应,所以氢气必须纯净,因此需要除去挥发出的氯化氢气体,因此装置B中盛放的试剂为碱石灰或生石灰;
故答案是:![]() ;干燥管;碱石灰或生石灰;
;干燥管;碱石灰或生石灰;
(3)装置E中盛放的是碱石灰,其作用是防止空气中的水蒸气进入D中,影响反应产生的水的检验;
故答案是:防止空气中水蒸气进入D中,对实验结果造成干扰;
(4)检查完装置气密性后,开始实验操作步骤:③关闭K3,打开K1、K2,排净装置内的空气;②在K2出口处收集一小试管气体验纯,以检验装置内空气是否排净;①关闭K2,打开K1、K3,点燃C处酒精灯,使氢气与过氧化钠发生反应;反应结束后,⑤熄灭C处酒精灯;继续通入氢气,直到④装置冷却后关闭K1 ;所以正确的顺序是③②①⑤④;
故答案是:③②①⑤④;
(5)若观察到D处干燥管中固体变蓝,反应产生水,则过氧化钠被还原为氧化钠,则C中发生反应的化学方程式为Na2O2+H2 ![]() Na2O +H2O(g);
Na2O +H2O(g);
故答案是:Na2O2+H2 ![]() Na2O +H2O(g)。
Na2O +H2O(g)。

 阅读快车系列答案
阅读快车系列答案