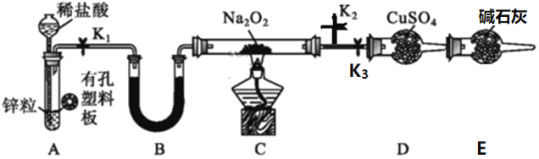
题目内容
【题目】下列物质的工业制备原理的方程式书写正确的是
A.氢氧化钠:Na2CO3+Ca(OH)2![]() CaCO3↓+2NaOH
CaCO3↓+2NaOH
B.乙醇:C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
C.二氧化硫:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.氯气:Ca(ClO)2+4HCl(浓)![]() CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
【答案】B
【解析】
A.NaOH在工业上用电解饱和食盐水的方法制取。方程式为2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH。A错误。
Cl2↑+H2↑+2NaOH。A错误。
B符合制取方法,方程式书写无误。
C.在工业上SO2是用煅烧黄铁矿的方法制取的。方程式为4FeS2+11O2![]() 2Fe2O3+8SO2↑,C错误。
2Fe2O3+8SO2↑,C错误。
D.在工业常用电解饱和食盐水的方法制氯气。方程式为2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH。D错误。
Cl2↑+H2↑+2NaOH。D错误。
答案选B。

练习册系列答案
相关题目
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,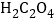 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快