题目内容
【题目】铍及其化合物的应用正日益被重视。
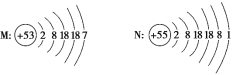
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的排布图为_______。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____。
(4)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
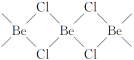
①a属于____(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为____(标出配位键)。
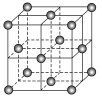
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所:
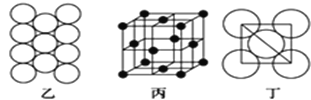
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___个;Al晶体的密度为_____(用字母表示)。
【答案】![]() BD Be原子半径比Al原子半径小,金属性更强 非极性
BD Be原子半径比Al原子半径小,金属性更强 非极性 ![]() 4
4 ![]()
【解析】
(1)Cr原子为24号元素,根据构造原理写出电子排布式,再去写价电子排布图;
(2)Be在第二周期第ⅡA族,Al在第三周期第ⅢA族,根据周期表和周期律分析作答;
(3)原子半径越小,金属性更强,熔点越高;
(4)①BeCl2无孤电子对,Be原子采取 sp 杂化方式,正负电荷中心重叠;
②两分子BeCl2聚合在一起,Be原子有空轨道,Cl原子有孤对电子,可以考虑分子间通过配位键结合在一起;
(5)Al的晶胞为面心立方最密堆积,利用均摊法计算Al原子的数目,再根据立体几何知识计算晶胞密度。
(1)Cr原子为24号元素,基态原子价层电子排布式为3d54s1,则基态Cr原子价电子的轨道表示式为![]() ;答案:
;答案:![]() ;
;
(2)A.铍属于s区元素,而铝属于p区主族元素,故A错误;
B.金属越活泼,电负性越小,Mg比Be、Al活泼,则两金属电负性都比镁大,故B正确;
C.Be的第一电离能比镁大,而Mg因s轨道全充满,第一电离能比Al大,故C错误;
D.Be2+和Al3+在溶液中均水解,则氯化物的水溶液pH均小于7,故D正确;
答案:BD;
(3)因为Be原子半径比Al原子半径小,金属性更强,则铍的熔点比铝的熔点高;答案: Be原子半径比Al原子半径小,金属性更强;
(4)①BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取 sp 杂化方式,是直线型,属于非极性分子;答案:非极性;
②在二聚分子(BeCl2)2中Be原子有空轨道,Cl原子有孤对电子,则配位键中电子对由氯原子提供,b 的结构式为![]() ;答案:
;答案:![]() ;
;
(5)Al的晶胞为面心立方最密堆积,则一个晶胞中Al原子的数目为8×1/8+6×1/2=4个;若已知Al的原子半径为b,则晶胞的边长为![]() ;NA代表阿伏加德罗常数,Al的相对原子质量为M,则Al晶体的密度为
;NA代表阿伏加德罗常数,Al的相对原子质量为M,则Al晶体的密度为![]() ;答案:4;
;答案:4;![]() 。
。

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
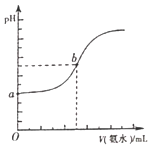
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
【题目】A、B、C、D、E为短周期元素,在元素周期表中的相对位置如图所示。A、C两元素原子的核外电子数之和等于B原子的质子数,B原子的质子数和中子数相等。
A | C | |
D | B | E |
请回答下列问题:
(1)E元素位于元素周期表中第________周期第________族。
(2)几种元素中最高价氧化物对应的水化物的酸性最强的是(用化学式表示)____________________。
(3)C元素的原子结构示意图为________,用电子式表示C的氢化物的形成过程:____________。
(4)由元素A、C及氢元素形成的化合物中含有的化学键类型为____________________。