题目内容
将相同质量的两铜片分别和浓硝酸、稀硝酸(两者均过量)反应,下列叙述正确的是
- A.出现钝化现象:浓硝酸会,稀硝酸不会
- B.消耗HNO3的物质的量:前者多,后者少
- C.反应生成气体的颜色:前者浅,后者深
- D.反应中转移的电子总数:前者多,后者少
B
试题分析:铜与浓硝酸、稀硝酸反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O ,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O A、浓硝酸、稀硝酸与铜均不会出现钝化现象,错误;B、由铜与浓硝酸、稀硝酸反应方程式可知,等质量的铜分别与浓、稀硝酸反应,浓硝酸消耗的物质的量多,正确;C、根据反应方程式知,铜与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,二氧化氮是红棕色气体,一氧化氮是无色气体,错误;D、根据方程式知,铜元素的化合价均由0价变为+2,1mol铜参加反应转移2mol电子,相同质量的铜与过量浓、稀硝酸反应转移电子数相等,错误。
考点:考查铜与浓、稀硝酸的反应。
试题分析:铜与浓硝酸、稀硝酸反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O ,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O A、浓硝酸、稀硝酸与铜均不会出现钝化现象,错误;B、由铜与浓硝酸、稀硝酸反应方程式可知,等质量的铜分别与浓、稀硝酸反应,浓硝酸消耗的物质的量多,正确;C、根据反应方程式知,铜与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,二氧化氮是红棕色气体,一氧化氮是无色气体,错误;D、根据方程式知,铜元素的化合价均由0价变为+2,1mol铜参加反应转移2mol电子,相同质量的铜与过量浓、稀硝酸反应转移电子数相等,错误。
考点:考查铜与浓、稀硝酸的反应。

练习册系列答案
相关题目
(本题共12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的c(H+)均增小 |
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________。
 (2008?北京)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.
(2008?北京)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.
 (08年北京卷)(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
(08年北京卷)(17分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。 (4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。

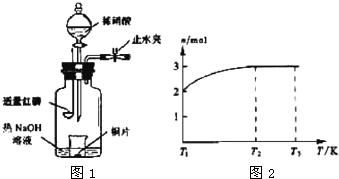
 (3)用图示装置制备NO并验证其还原性。有下列主要操作:
(3)用图示装置制备NO并验证其还原性。有下列主要操作: (4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。