题目内容
 (2008?北京)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.
(2008?北京)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y
| △ |
(1)Y的电子式是


(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是
2NH3(l)?NH2-+NH4+
2NH3(l)?NH2-+NH4+
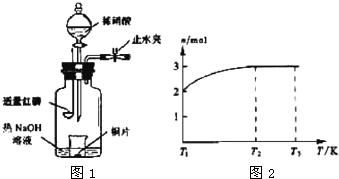
.(3)用图1所示装置制备NO并验证其还原性.有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中.
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞.
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸.
①步骤c后还缺少的一步主要操作是
打开止水夹,通入少量氧气
打开止水夹,通入少量氧气
.②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是
P2O5+6OH-=2PO43-+3H2O
P2O5+6OH-=2PO43-+3H2O
.③步骤c滴入稀硝酸后烧杯中的现象是
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
,反应的离子方程式是Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色
Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色
.(4)一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色.温度由T1继续升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图2所示.
①温度在T1-T2之间,反应的化学方程式是
2NO2?2NO+O2
2NO2?2NO+O2
.②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)
30.7
30.7
.分析:(1)(2)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,考虑为10电子微粒,通常状况下,W为无色液体判断为H2O;X有5个原子核,发生反应X+Y
Z+W,饮食NH4++OH-=NH3↑+H2O,推断X为NH4+、Y为OH-、Z为NH3;
(3)装置用来制备NO并验证其还原性,先制备无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮;
(4)①温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2;
②温度在T2-T3之间处于平衡状态,平衡时混合气体总的物质的量为3mol,根据起始加入1molN2O4计算混合气体总质量,计算混合气体的平均摩尔质量确定平均相对分子质量.
| △ |
(3)装置用来制备NO并验证其还原性,先制备无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮;
(4)①温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2;
②温度在T2-T3之间处于平衡状态,平衡时混合气体总的物质的量为3mol,根据起始加入1molN2O4计算混合气体总质量,计算混合气体的平均摩尔质量确定平均相对分子质量.
解答:解:(1)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,考虑为10电子微粒,通常状况下,W为无色液体判断为H2O;X有5个原子核,发生反应X+Y
Z+W,饮食NH4++OH-=NH3↑+H2O,推断X为NH4+、Y为OH-、Z为NH3,Y的电子式为 ,故答案为:
,故答案为: ;
;
(2)液态Z为NH3与W为H2O的电离相似,都可电离出电子数相同的两种离子,液态NH3的电离方程式是2NH3(l)?NH2-+NH4+;故答案为:2NH3(l)?NH2-+NH4+;
(3)装置用来制备NO并验证其还原性,先制备无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮,
①由上述分析可知,步骤c后还缺少的一步主要操作是:打开止水夹,通入少量氧气,故答案为:打开止水夹,通入少量氧气;
②红磷充分燃烧的产物为P2O5,与NaOH溶液反应的离子方程式是P2O5+6OH-=2PO43-+3H2O,故答案为:P2O5+6OH-=2PO43-+3H2O;
③步骤c滴入稀硝酸后烧杯中,发生反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,现象是:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色;
(4)①温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2,方程式为:2NO2?2NO+O2,
故答案为:2NO2?2NO+O2;
②温度在T2-T3之间处于平衡状态,平衡时混合气体总的物质的量为3mol,起始加入1molN2O4,故平衡混合气体总质量=1mol×92g/mol=92g,混合气体的平均摩尔质量=
=30.7g/mol,故混合气体的平均相对分子质量为30.7,故答案为:30.7.
| △ |
 ,故答案为:
,故答案为: ;
;(2)液态Z为NH3与W为H2O的电离相似,都可电离出电子数相同的两种离子,液态NH3的电离方程式是2NH3(l)?NH2-+NH4+;故答案为:2NH3(l)?NH2-+NH4+;
(3)装置用来制备NO并验证其还原性,先制备无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮,
①由上述分析可知,步骤c后还缺少的一步主要操作是:打开止水夹,通入少量氧气,故答案为:打开止水夹,通入少量氧气;
②红磷充分燃烧的产物为P2O5,与NaOH溶液反应的离子方程式是P2O5+6OH-=2PO43-+3H2O,故答案为:P2O5+6OH-=2PO43-+3H2O;
③步骤c滴入稀硝酸后烧杯中,发生反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,现象是:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色;
(4)①温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2,方程式为:2NO2?2NO+O2,
故答案为:2NO2?2NO+O2;
②温度在T2-T3之间处于平衡状态,平衡时混合气体总的物质的量为3mol,起始加入1molN2O4,故平衡混合气体总质量=1mol×92g/mol=92g,混合气体的平均摩尔质量=
| 92g |
| 3mol |
点评:本题考查无机物推断、化学实验、化学平衡等,注意一氧化氮的制备应在没有氧气条件下进行,(4)中方程式的书写为易错点,学生容易认为NO2转化为N2O4,忽略混合气体物质的量增大.

练习册系列答案
相关题目
 是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生化学反应的产物.
是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生化学反应的产物.




 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O