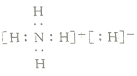题目内容
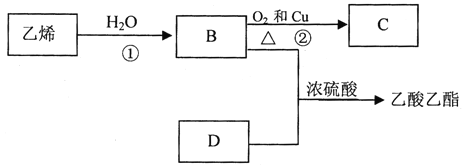
【题目】为探究白色固体X(仅含两种元素)的组成和性质,设计并完成如下实验(所加试剂都是过量的):
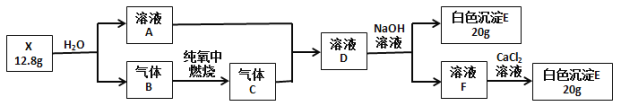
其中气体B在标准状况下的密度为1.16 g·L-1请回答:
(1) X的化学式是________。
(2) 气体B的电子式________。
(3) 溶液D与NaOH溶液反应的离子反应方程式是_______________。
【答案】CaC2 2![]() 2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+ CO32-
2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+ CO32-
【解析】
由气体B在标准状况下的密度为1.16 g·L-1,则M(B)=1.16 g·L-1 ![]() 22.4 L·mol-1=26 g·mol-1,结合固体X与水反应生成气体B和溶液A可推知,X为CaC2,气体B为C2H2,A为氢氧化钙溶液,C为CO2气体,D为Ca(HCO3)2溶液,F为Na2CO3进行分析。
22.4 L·mol-1=26 g·mol-1,结合固体X与水反应生成气体B和溶液A可推知,X为CaC2,气体B为C2H2,A为氢氧化钙溶液,C为CO2气体,D为Ca(HCO3)2溶液,F为Na2CO3进行分析。
(1) 结合上述分析可知X为碳化钙,其化学式是CaC2。答案:CaC2。
(2) 气体B为乙炔,属于共价化合物,其电子式为![]() 。答案:
。答案:![]() 。
。
(3) 溶液D为碳酸氢钙溶液,与足量NaOH溶液反应的离子反应方程式是2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+ CO32-,答案:2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+ CO32-。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目