题目内容
15.碱存在下,卤代烃与醇反应生成醚(R-O-R′):R-X+R′OH$\stackrel{KOH室温}{→}$ R-O-R′+HX化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下:
请回答下列问题:
(1)1mol A和1mol H2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为C4H10O
A分子中所含官能团的名称是碳碳双键和羟基
(2)第②步反应类型为取代.
(3)化合物B具有的化学性质(填写字母代号)是abc
a.可发生氧化反应b.强酸或强碱条件下均可发生消去反应
c.可发生酯化反应d.催化条件下可发生加聚反应
(4)写出D或E的结构简式:D或E
 、
、 .
.(5)写出化合物C与NaOH水溶液反应的化学方程式:
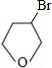 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$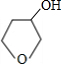 +NaBr.
+NaBr.
分析 Y为饱和一元醇,设其分子式为CnH2n+2O,则其中C的质量分数为$\frac{12n}{12n+2n+2+16}$×100%=65%,得n=4,即Y的分子式为C4H10O,1molA和1molH2恰好反应生成饱和一元醇,且A能和Br2/CCl4反应,说明A分子中含有C=C,所以A中还含有-OH,由信息卤代烃与醇反应生成醚,结合四氢呋喃的结构,可知A为CH2=CHCH2CH2OH,A和溴发生加成反应生成B,则B为CH2BrCHBrCH2CH2OH,B发生取代反应生成C,C为 ,C发生消去反应生成D和E,D和E为
,C发生消去反应生成D和E,D和E为 、
、 ,据此分析解答.
,据此分析解答.
解答 解:Y为饱和一元醇,设其分子式为CnH2n+2O,则其中C的质量分数为$\frac{12n}{12n+2n+2+16}$×100%=65%,得n=4,即Y的分子式为C4H10O,1molA和1molH2恰好反应生成饱和一元醇,且A能和Br2/CCl4反应,说明A分子中含有C=C,所以A中还含有-OH,由信息卤代烃与醇反应生成醚,结合四氢呋喃的结构,可知A为CH2=CHCH2CH2OH,A和溴发生加成反应生成B,则B为CH2BrCHBrCH2CH2OH,B发生取代反应生成C,C为 ,C发生消去反应生成D和E,D和E为
,C发生消去反应生成D和E,D和E为 、
、 ,
,
(1)通过以上分析知,A的分子式为C4H10O,A为CH2=CHCH2CH2OH,A中官能团名称是碳碳双键和羟基,
故答案为:C4H10O;羟基和碳碳双键;
(2)第②步反应类型为取代反应,故答案为:取代;
(3)B为CH2BrCHBrCH2CH2OH,
a.含有醇羟基,所以可发生氧化反应,故正确;
b.含有溴原子和醇羟基,且连接溴原子和醇羟基碳原子相邻碳原子上含有氢原子,所以强酸或强碱条件下均可发生消去反应,故正确;
c.含有醇羟基,所以可发生酯化反应,故正确;
d.不含碳碳不饱和键,所以催化条件下不可发生加聚反应,故错误;
故选abc;
(4)D和E为 、
、 ,故答案为:
,故答案为: 、
、 ;
;
(5)C和氢氧化钠的水溶液在加热条件下发生取代反应,反应方程式为 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr,
+NaBr,
故答案为: +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr.
+NaBr.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,正确判断A结构是解本题关键,再结合反应条件、某些物质的结构简式进行推断,注意题给信息的灵活运用,题目难度中等.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 已烯、苯、四氯化碳 | B. | 已炔、己烯、四氯化碳 | ||
| C. | 已烷、苯、乙醇 | D. | 甲苯、苯、已烯 |
| A. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀合金材料的元素 | |
| B. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| C. | 在地球上元素的分布和它们在元素周期表中的位置有密切关系 | |
| D. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 在此反应中,每生成1molO2(PtF6),则转移1mol电子 | |
| B. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| C. | O2(PtF6)中氧元素的化合价是+1价 | |
| D. | O2(PtF6)中仅存在离子键不存在共价键 |
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.