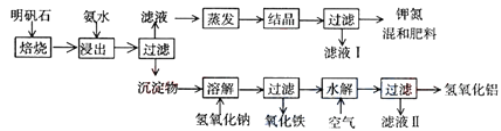
题目内容
【题目】制氯酸锶[Sr(ClO3)2]的实验装置如下。回答下列问题
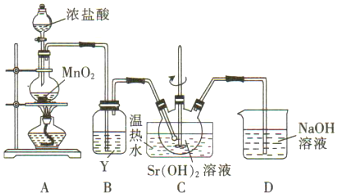
(1)装置A中浓盐酸在反应中的作用是_____.
(2)Y是_____(填字母).
A.浓H2SO4 B.饱和NaCl溶液 C.NaOH溶液
(3)装置D中NaOH溶液的作用是_____.
(4)C中反应的氧化剂与还原剂的质量比为_____.
【答案】还原性和酸性 B 吸收氯气 5:1
【解析】
(1)装置A中发生的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,通过产物判断浓盐酸在反应中的作用。
MnCl2+Cl2↑+2H2O,通过产物判断浓盐酸在反应中的作用。
(2)浓盐酸易挥发,所以制得的氯气中混有氯化氢和水蒸气。
A.浓H2SO4只能吸收水蒸气;
B.饱和NaCl溶液,可吸收氯气中的氯化氢;
C.NaOH溶液,既能吸收氯化氢,又能吸收氯气;
(3)装置D中NaOH溶液的作用是尾气处理。
(4)C中发生的反应为6Cl2+6Sr(OH)2==5SrCl2+Sr(ClO3)2+6H2O,从而得出氧化剂与还原剂的质量比。
(1)装置A中发生的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,反应生成Cl2,Cl元素的价态升高,HCl表现出还原性;反应生成MnCl2时,HCl表现出酸性。答案为:还原性和酸性;
MnCl2+Cl2↑+2H2O,反应生成Cl2,Cl元素的价态升高,HCl表现出还原性;反应生成MnCl2时,HCl表现出酸性。答案为:还原性和酸性;
(2)浓盐酸易挥发,所以制得的氯气中混有氯化氢和水蒸气,除杂质的目的主要是除去氯化氢。
A.浓H2SO4只能吸收水蒸气,不能去除氯化氢,A不合题意;
B.饱和NaCl溶液,可吸收氯气中的氯化氢,对氯气不产生影响,B符合题意;
C.NaOH溶液,既能吸收氯化氢,又能吸收氯气,C不合题意。答案为:B;
(3)装置D中NaOH溶液的作用是吸收氯气,防止污染环境。答案为:吸收氯气;
(4)C中发生的反应为6Cl2+6Sr(OH)2==5SrCl2+Sr(ClO3)2+6H2O,生成SrCl2的Cl2表现出氧化性,作氧化剂,生成Sr(ClO3)2的Cl2表现出还原性,作还原剂,从而得出氧化剂与还原剂的质量比5:1。答案为:5:1。

【题目】现有反应:mA(g)+nB(g)![]() pC(g)
pC(g)
(I)若达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为___热反应,且m+n__p(填“>”、“=”或“<”)。
(2)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色___;而维持容器内压强不变,充入氖气时,混合物颜色___。(填“变深”、“变浅”或“不变”)。
(II)若在容积可变的密闭容器中发生反应,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105Pa增加到5×105Pa时,平衡___移动(填:向左,向右,不)。
(2)维持压强为2×105Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入b molB,当重新达到平衡时,体系中气体总物质的量是___mol。
(3)当压强为1×106Pa时,此反应的平衡常数表达式:___。
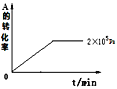
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105Pa时,A的转化率随时间变化如图,请在图中补充画出压强分别为5×105Pa和1×106Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。____