题目内容
10.在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g•cm-3,质量分数为w,物质的量浓度为c mol•L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S.则下列关系中不正确的是( )| A. | S=$\frac{100w}{1-w}$ | B. | w=$\frac{4c}{d}$% | ||
| C. | S=$\frac{4000c}{1000d-40c}$ | D. | C=$\frac{m}{40V}$ |
分析 根据n=$\frac{m}{M}$、c=$\frac{n}{V}$、c=$\frac{1000ρw}{M}$计算出氢氧化钠溶液的物质的量浓度;根据溶解度=$\frac{溶质质量}{溶剂质量}$×100g计算出该温度下氢氧化钠的溶解度,根据$\frac{溶质质量}{溶液质量}$×100%计算溶质的质量分数,以此计算解答.
解答 解:A.该氢氧化钠溶液的质量分数为w,则100g溶液中溶质的质量为100w克,溶剂的质量为(100-100w)g,该温度下氢氧化钠的溶解度为:S=$\frac{100w}{100-100w}$×100g=$\frac{100w}{1-w}$g,故A正确;
B.溶液中所含氢氧化钠的质量为m g,溶液质量为ρVg,质量分数为$\frac{m}{dV}$×100%,或由c=$\frac{1000ρw}{M}$可知质量分数w=$\frac{40c}{1000d}$=$\frac{4c}{d}$%,故B正确;
C.由A得S=$\frac{100w}{1-w}$,B得w=$\frac{40c}{1000d}$,所以S=$\frac{4000c}{1000d-40c}$,故C正确;
D.溶液中所含氢氧化钠的质量为mg.溶质的物质的量为$\frac{m}{40}$mol,溶液体积为V×10-3L,则溶液中溶质的物质的量浓度c=$\frac{m}{40V}$×1000 mol•L-1,故D错误;
故选D.
点评 本题考查物质的量浓度的有关计算,为高频考点,把握物质的量为中心的基本计算及相关计算公式为解答的关键,侧重分析、理解能力及化学计算能力的考查,题目难度中等.

练习册系列答案
相关题目
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1molCl2与足量的铁反应生成FeCl3,转移的电子数是3NA | |
| B. | 1mol氧气含有的原子数是1mol氖气含有的原子数的两倍 | |
| C. | 7.8g Na2O2中含有阴离子的数目为0.1NA,与足量水反应时电子转移了0.1NA | |
| D. | 在标准状况下,NA个水分子所占有的体积约为22.4L |
18.在化学学习中使用数轴的表示方法可起到直观、形象的效果,下列表达中不正确的是( )
| A. | 常温下溶液的pH与酸碱性的关系: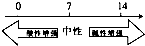 | |
| B. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| C. | Fe在Cl2中的燃烧产物: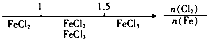 | |
| D. | 氨水与SO2反应后溶液中的铵盐: |
2.H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示,下列说法正确的是( )

| A. | 有MnO2条件下的反应曲线是a曲线 | |
| B. | a曲线变为b曲线,反应的活化分子百分数增大 | |
| C. | a曲线变为b曲线,平衡时H2O2的转化率增大 | |
| D. | b曲线的热化学方程式为:H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-(E1-E2)KJ•mol-1 |
 .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑,将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑,将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.