题目内容
【题目】五氯化磷(PCl5)是有机合成中重要的氯化剂,易发生PCl5(s)![]() PCl3(g)+Cl2(g)反应。温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)反应。温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 相同条件下,起始时向容器中充入2.0 mol PCl5,PCl5的分解率增大
B. 只升高温度,平衡时c(PCl5)=0.12 mol/L,则正反应是放热反应
C. 反应在前50 s的平均速率v(PCl3)=0.0032 mol/(L·s)
D. 在密闭低温的条件下,有利于PCl5固体的保存
【答案】D
【解析】A. 相同条件下,起始时向容器中充入2.0 mol PCl5,恒容条件下相当于增大压强,平衡向气体体积缩小的逆方向移动,PCl5的分解率减小,选项A错误;B、温度为T时,平衡时n(PCl3)=0.20 mol,则n(PCl5)=0.80 mol,c(PCl5)=0.40 mol,升高温度,平衡时c(PCl5)=0.12 mol/L,则反应向正方向移动,正反应是吸热反应,选项B错误;C、反应在前50 s的平均速率v(PCl3)=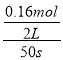 =0.0016 mol/(L·s),选项C错误;D、正反应为吸热反应,故降低温度平衡向逆反应方向移动,在密闭低温的条件下,有利于PCl5固体的保存,选项D正确。答案选D。
=0.0016 mol/(L·s),选项C错误;D、正反应为吸热反应,故降低温度平衡向逆反应方向移动,在密闭低温的条件下,有利于PCl5固体的保存,选项D正确。答案选D。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】下图所示的实验,不能达到实验目的的是
A | B | C | D |
|
|
|
|
结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡移动的影响 | 探究精炼铜的原理 | 证明酸性 CH3COOH>H2CO3>H3BO3 |
A. A B. B C. C D. D
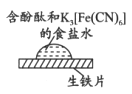
【题目】某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水
| 放置一段时间后,生铁片上出现如图所示“斑痕”。边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
|
下列对实验现象解释不正确的是
A. 中心区为蓝色的原因是铁失电子被氧化,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀
B. 边缘处为红色的原因是发生吸氧腐蚀,生成了OH-,使溶液中c(OH-)>c(H+)
C. 边缘处为红色的原因是发生析氢腐蚀,消耗了H+,打破了水的电离平衡,使c(OH-)>c(H+)
D. 交界处出现铁锈的原因是4Fe2++8OH-+O2+2H2O=4Fe(OH)3,Fe(OH)3分解得到铁锈