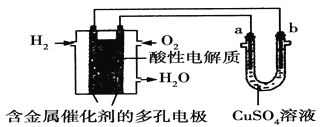
题目内容
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH![]() )/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
【答案】A
【解析】水的离子积常数KW只与温度有关,若外加酸、碱, c(H+)或c(OH-)增大,抑制水的电离;若外加盐,如加入氯化钠不影响水的电离,加入碳酸钠促进水电离,故A正确;Ksp与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,故B错误;NH3·H2O的电离平衡常数只与温度有关,所以NH3·H2O溶液中加入少量NH4Cl晶体,Kb不变,故C错误;醋酸中![]() ,氨水中
,氨水中![]() ,所以只有同浓度的CH3COOH、NH3·H2O溶液中的c(H+)与c(OH-)才相等,故D错误。
,所以只有同浓度的CH3COOH、NH3·H2O溶液中的c(H+)与c(OH-)才相等,故D错误。

练习册系列答案
相关题目