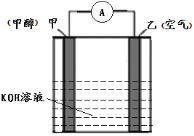
题目内容
【题目】Cu、Fe、Se、Co、S、P等元素常用于化工材料的合成。请回答下列问题:
(1)Fe3+最外层电子排布式为___________,其核外共有_____种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是_______________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为_________________(用元素符号表示),SeO2分子的空间构型为___________________。
(3)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为__________,每个P4S3分子中含孤电子对的数目为_______________。

(4)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为a cm,则该氧化物的密度为________g·cm-3。(设阿伏加德罗常数的值为NA)。

【答案】 3s23p63d5 23 Fe3+的电子排布为 [Ar]3d5 ,3d轨道为半充满状态,比Fe2+电子排布[Ar]3d6 更稳定 Br >Se > As Ⅴ形 sp3 10 ![]()
【解析】 (1) Fe原子核电荷数为26,电子排布式[Ar]3d64s2, Fe3+最外层电子排布式为3s23p63d5;其核外共有23种不同运动状态的电子;Fe3+比Fe2+更稳定的原因是Fe3+的电子排布为 [Ar]3d5 ,3d轨道为半充满状态,比Fe2+电子排布[Ar]3d6 更稳定;正确答案:3s23p63d5;23;Fe3+的电子排布为 [Ar]3d5 ,3d轨道为半充满状态,比Fe2+电子排布[Ar]3d6 更稳定。
(2) 同一周期元素,从左到右,电负性增大,所以三种元素的电负性从大到小的顺序为Br >Se > As;因为SeO2中Se中心原子有两对孤电子对, 所以它是V形结构;正确答案:Br >Se > As;Ⅴ形。
(3)从P4S3分子的结构可以看出,S原子形成两个键,考虑到S原子本身价层含有两对孤电子对,成键是3p中的单电子成键,因此杂化轨道为不等性的sp3 杂化;1个P4S3分子中含有4个P和3个S,一个P含有1对孤电子对,1个S含有2对孤电子对,则每个![]() 分子含有的孤电子对数为
分子含有的孤电子对数为![]() ;正确答案:sp3 ; 10。
;正确答案:sp3 ; 10。
(4)根据晶胞的结构可知,含有铜原子个数为4,氧原子个数为8×1/8+1=2,所以该晶胞含有2个Cu2O,该晶胞的边长为acm,则晶胞的体积为a3cm3 ,设晶体的密度为ρg·cm-3,晶胞中含有氧化亚铜的质量为2×144/NA=288/NAg,所以a3=288/ρNA,所以ρ=![]() g·cm-3;正确答案:
g·cm-3;正确答案:![]() 。
。