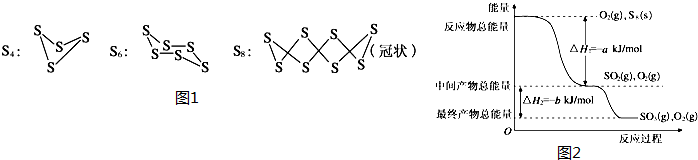
题目内容
14.硒(Se)是硫的同族元素,有关SeO2两个化学反应如下,下列有关叙述正确的是( )①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O.
| A. | ①中Se是氧化产物,I2是还原产物 | |
| B. | SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是 H2SO4(浓)>SeO2>I2 | |
| C. | 常温常压下,Se是固体,其最高价氧化物对应的水化物是H2SeO4 | |
| D. | 反应①中每有0.6 mol I2生成,转移电子数目为2.4NA |
分析 反应①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O中,Se元素的化合价降低,被还原,I元素的化合价升高,被氧化;反应②Se+2H2SO4(浓)=2SO2↑+□+2H2O中,Se元素化合价升高,被氧化,S元素化合价降低,被还原,根据在同一反应中氧化剂氧化性大于氧化产物氧化性判断氧化性强弱,结合元素化合价的变化计算转移电子数目.
解答 解:A.反应①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O中,Se元素的化合价降低,被还原,I元素的化合价升高,被氧化,则Se是还原产物,I2是氧化产物,故A错误;
B.在同一反应中氧化剂氧化性大于氧化产物氧化性,则根据①可知氧化性:SeO2>I2,②中方框中物质应为SeO2,氧化性:H2SO4(浓)>SeO2,则氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2,故B正确;
C.硒(Se)是硫的同族元素,性质与S相似,常温下为固体,最高化合价为+6价,其最高价氧化物对应的水化物是H2SeO4,故C正确;
D.根据化合价的变化可知,反应①中每有0.6molI2生成,转移的电子数目应为0.6mol×2×(1-0)=1.2mol,故D错误.
故选BC.
点评 本题考查氧化还原,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意根据在同一反应中氧化剂氧化性大于氧化产物氧化性来判断氧化性的强弱.

练习册系列答案
相关题目
4.下列说法不正确的是( )
①有机物都是含碳、氢的混合物
②六大营养素都是有机物
③有机物都易燃烧
④有机物都是非电解质
⑤分子中只含C-C和C-H键的化合物一定是烷烃
⑥含苯环的化合物一定是芳香烃.
①有机物都是含碳、氢的混合物
②六大营养素都是有机物
③有机物都易燃烧
④有机物都是非电解质
⑤分子中只含C-C和C-H键的化合物一定是烷烃
⑥含苯环的化合物一定是芳香烃.
| A. | ①②③④⑤⑥ | B. | ①②③⑥ | C. | ②③④⑤ | D. | ①②③④⑤ |
5.下列实验装置(固定装置略去)和操作正确( )
| A. | 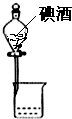 分离碘酒中的碘 | B. | 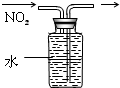 排水法收集NO2 | ||
| C. | 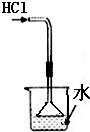 吸收HCl尾气 | D. | 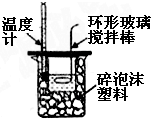 中和热的测定 |
2.下列事实中,不能用勒沙特列原理解释的是( )
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 工业合成氨时选择铁做催化剂能极大加快反应速率 | |
| C. | 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 | |
| D. | 工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
19.下列有关化学实验安全问题的叙述中,正确的是( )
| A. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 | |
| B. | 制取并用排水法收集氧气结束后,应立即停止加热 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 金属钠着火,应该立即用水扑灭 |
6.已知氧化性:Cl2>Br2>Fe3+;还原性:Fe2+>Br->Cl-.向FeBr2溶液中通入Cl2至过量,因Cl2的量不同溶液中的反应情况不同,其中错误的是( )
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Br-+Cl2═Br2+2Cl- | |
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
3.下列说法正确的是( )
| A. | 化合反应都是氧化还原反应 | |
| B. | 复分解反应都不是氧化还原反应 | |
| C. | 在反应 2H2S+SO2=3S+2H2O中,还原剂是SO2 | |
| D. | 在一个氧化还原反应中,同一种反应物不可能既是氧化剂又是还原剂 |