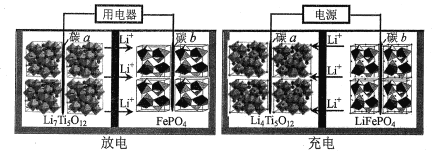
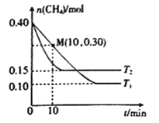
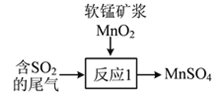
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.7.8 g的Na2S和Na2O2的混合物中含有阴、阳离子总数为0.3 NA
B.常温常压下,22.4 LCO2中含有NA个CO2分子
C.1.0 L 1.0 mol·L-1的NaClO水溶液中含有的氧原子数为NA
D.常温常压下,18 g羟基(-O2H)中所含的中子数为8 NA
【答案】A
【解析】
A.7.8g硫化钠和过氧化钠的物质的量为0.1mol,0.1mol硫化钠和过氧化钠的混合物中含有0.2mol钠离子和0.1mol硫离子与过氧根离子的混合物,总共含有0.3mol离子,含有的离子总数为0.3NA,故A正确;
B. 常温常压下,气体摩尔体积不等于22.4L/mol,故B错误;
C. 1.0 L 1.0 mol·L-1的NaClO水溶液中含有的氧原子数目大于NA,因为水中也含有氧原子,故C错误;
D. 常温常压下,18 g羟基(-O2H)中所含的中子数为N=![]() ×NA=
×NA=![]() ×10NA=10 NA,故D错误;
×10NA=10 NA,故D错误;
故选:A。

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
【题目】下表中各粒子对应的立体构型及杂化方式均正确的是
选项 | 粒子 | 立体构型 | 杂化方式 |
A | SO3 | 平面三角形 | S原子采取sp2杂化 |
B | SO2 | V形 | S原子采取sp3杂化 |
C | CO32- | 三角锥形 | C原子采取sp2杂化 |
D | BeCl2 | 直线性 | Be原子采取sp杂化 |
A.AB.BC.CD.D