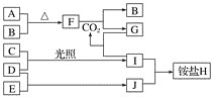
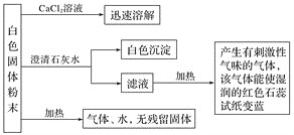
题目内容
【题目】下表中各粒子对应的立体构型及杂化方式均正确的是
选项 | 粒子 | 立体构型 | 杂化方式 |
A | SO3 | 平面三角形 | S原子采取sp2杂化 |
B | SO2 | V形 | S原子采取sp3杂化 |
C | CO32- | 三角锥形 | C原子采取sp2杂化 |
D | BeCl2 | 直线性 | Be原子采取sp杂化 |
A.AB.BC.CD.D
【答案】AD
【解析】
A.SO3 分子中价层电子对个数=σ键个数+孤电子对个数=3+![]() (6-3×2)=3,所以硫原子采用sp2杂化,为平面三角形结构,故A正确;
(6-3×2)=3,所以硫原子采用sp2杂化,为平面三角形结构,故A正确;
B.SO2的价层电子对个数=2+![]() (6-2×2)=3,硫原子采取sp2杂化,该分子为V形结构,故B错误;
(6-2×2)=3,硫原子采取sp2杂化,该分子为V形结构,故B错误;
C.碳酸根离子中价层电子对个数=σ键个数+孤电子对个数=3+![]() (4+2-3×2)=3,所以原子杂化方式是sp2,为平面三角形结构,故C错误;
(4+2-3×2)=3,所以原子杂化方式是sp2,为平面三角形结构,故C错误;
D.BeCl2分子中每个Be原子含有2个σ键,价层电子对个数是2,没有孤电子对,为sp杂化,为直线型,故D正确;
故选AD。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
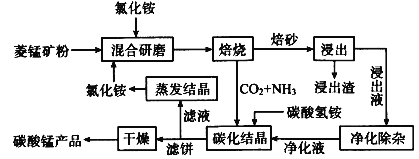
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1molL -1形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为___。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②__将Al3+、Fe3+变为沉淀除去;③加入NH4F将__离子沉淀除去。写出反应①的离子方程式为___;
(3)碳化结晶时,反应的离子方程式为___。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是__。流程中能循环利用的物质除了氯化铵之外还有__。
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度__(填“偏高”“偏低”或“无影响”)。