题目内容
(14分)下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
二 |
|
|
|
⑥ |
|
⑦ |
|
|
|
三 |
① |
③ |
⑤ |
|
|
|
⑧ |
⑩ |
|
四 |
② |
④ |
|
|
|
|
⑨ |
|
(1) ⑧⑨三种元素形成的气态氢化物最稳定的是___________________________。
(2) 写出①的最高价氧化物对应的水化物的电子式________ 。
(3) ②③④中形成的简单离子半径由大到小的顺序是________________________。
(4) 用电子式表示元素⑦的氢化物的形成过程________ ,该氢化物与元素⑧的单质反应的离子方程式是______________________________。
(5) ①和⑨两元素形成化合物的化学式为_________________________,该化合物的溶液与元素⑧的单质反应的离子方程式为___________________ 。
(1)HF (2)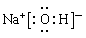 (3)K+>Ca2+>Mg2+
(3)K+>Ca2+>Mg2+
(4)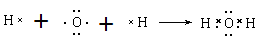 、Cl2+H2O=HCl+HclO
、Cl2+H2O=HCl+HclO
(5)NaBr 2Br-+Cl2=Br2+2Cl-
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知①是Na、②是K、③是Mg、④是Ca、⑤是Al、⑥是C、⑦是O、⑧是Cl、⑨是Br、⑩是Ar、是F。
(1)同主族元素自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱。
(2)钠的最高价氧化物对应的水化物是氢氧化钠,是离子化合物。
(3)同主族元素自上而下原子半径和;离子半径均是逐渐增大的。同周期元素自左向右原子半径逐渐减小,阳离子半径逐渐也逐渐减小,所以顺序为K+>Ca2+>Mg2+。
(4)O的氢化物是水,形成的化学键是极性键,形成过程为
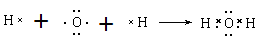 。氯气溶于水生成氯化氢和次氯酸,方程式为Cl2+H2O=HCl+HClO。
。氯气溶于水生成氯化氢和次氯酸,方程式为Cl2+H2O=HCl+HClO。
(5)氯的非金属性强于溴的,,可以将溴离子氧化生成单质单质溴,反应式为2Br-+Cl2=Br2+2Cl-。