题目内容
下列为元素周期表中的一部分,按要求回答下列问题.
(1)这些元素中最不活泼的元素名称为:
(2)元素⑥⑦=10 ⑩的最高价氧化物对应的水化物中碱性最强的是:
(3)元素⑨的单质与H2O反应的离子方程式为:
(4)元素③的单质电子式为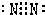
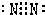 ;
;
(5)元素①③⑨形成的化合物中的化学键类型为:
(6)比较元素⑥⑦⑧⑨离子的半径由大到小的顺序为:
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | =10 ⑩ | |||||||
氖
氖
;(2)元素⑥⑦=10 ⑩的最高价氧化物对应的水化物中碱性最强的是:
KOH
KOH
;(3)元素⑨的单质与H2O反应的离子方程式为:
Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
;(4)元素③的单质电子式为
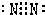
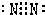
(5)元素①③⑨形成的化合物中的化学键类型为:
离子键和共价键
离子键和共价键
.(6)比较元素⑥⑦⑧⑨离子的半径由大到小的顺序为:
S2->Cl->Na+>Mg2+
S2->Cl->Na+>Mg2+
.分析:(1)稀有气体元素的化学性质最不活泼;
(2)根据元素周期表中的酸性递变规律来回答;
(3)氯气和水反应生成盐酸和次氯酸;
(4)氮气是含有氮氮三键的物质,根据电子式的书写方法来回答;
(5)铵盐均为离子化合物,含有离子键和共价键;
(6)离子的电子层越多半径越大,对于核外电子排布相等的离子,则核电荷数越多半径越小.
(2)根据元素周期表中的酸性递变规律来回答;
(3)氯气和水反应生成盐酸和次氯酸;
(4)氮气是含有氮氮三键的物质,根据电子式的书写方法来回答;
(5)铵盐均为离子化合物,含有离子键和共价键;
(6)离子的电子层越多半径越大,对于核外电子排布相等的离子,则核电荷数越多半径越小.
解答:解:根据元素在周期表中的分布,可以推知①是H,②是C,③是N,④是O,⑤是Ne,⑥是Na,⑦是Mg,⑧是S,⑨是Cl,⑩是K.
(1)稀有气体元素的化学性质最不活泼,应该是Ne,故答案为:氖;
(2)周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以碱性最强的是KOH,故答案为:KOH;
(3)氯气和水反应生成盐酸和次氯酸,离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(4)氮气是含有氮氮三键的物质,它的电子式为: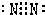 ,故答案为:
,故答案为: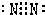 ;
;
(5)①③⑨三元素形成的化合物为NH4Cl,为离子化合物,含有离子键和共价键,故答案为:离子键和共价键;
(6)离子的电子层越多半径越大,所以硫离子、氯离子的半径大于钠离子、镁离子,对于核外电子排布相等的离子,则核电荷数越多半径越小,
所以离子半径顺序是:S2->Cl->Na+>Mg2+,故答案为:S2->Cl->Na+>Mg2+.
(1)稀有气体元素的化学性质最不活泼,应该是Ne,故答案为:氖;
(2)周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以碱性最强的是KOH,故答案为:KOH;
(3)氯气和水反应生成盐酸和次氯酸,离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(4)氮气是含有氮氮三键的物质,它的电子式为:
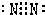 ,故答案为:
,故答案为: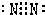 ;
;(5)①③⑨三元素形成的化合物为NH4Cl,为离子化合物,含有离子键和共价键,故答案为:离子键和共价键;
(6)离子的电子层越多半径越大,所以硫离子、氯离子的半径大于钠离子、镁离子,对于核外电子排布相等的离子,则核电荷数越多半径越小,
所以离子半径顺序是:S2->Cl->Na+>Mg2+,故答案为:S2->Cl->Na+>Mg2+.
点评:本题考查学生元素周期表的结构和元素周期律知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目

