��Ŀ����
����Ŀ���ߴ��辧������Ϣ��������Ҫ���ϡ�
��1����ҵ����ʯӢ�ͽ�̿�����Ƶôֹ衣��֪��Ӧ���̵������仯����ͼ


д����ʯӢ�ͽ�̿��ȡ�ֹ���Ȼ�ѧ����ʽ______________________________��
��2��ijͬѧ������������Ʊ��ߴ��裺

��Y�Ļ�ѧʽΪ____________________��
��д����ӦI�����ӷ���ʽ________________________________________��
��д����ӦIV�Ļ�ѧ����ʽ________________________________________��
�ܼ���ֽ���¶�ԶԶ���ڹ��飨SiH4������ԭ�ӽṹ������ԭ��______________________________��
��3�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ衣�䷴Ӧ��SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����
Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����

A���÷�Ӧ�Ƿ��ȷ�Ӧ
B���������ʾ��Ͷ�ϱȿ�����![]()
C���÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D��ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ
���𰸡� SiO2(s)+2C(s)=Si(s)+2CO(g) H=+638.4kJ/mol H2SiO3��H4SiO4 SiO2+2OH-=SiO32-+H2O SiO2+4Mg![]() Mg2Si+2MgO ���ڱ��У�����̼����ͬ���壬ԭ�Ӱ뾶Si����C����Ԫ�صķǽ���������̼Ԫ�أ���������ȶ������ڼ��� BC��
Mg2Si+2MgO ���ڱ��У�����̼����ͬ���壬ԭ�Ӱ뾶Si����C����Ԫ�صķǽ���������̼Ԫ�أ���������ȶ������ڼ��� BC��
����������1�������Ȼ�ѧ��Ӧ����ʽ�ļ��㣬���ݵ�һ��ͼ���Ȼ�ѧ��Ӧ����ʽΪSi(s)��O2(g)=SiO2(s) ��H=��859.4kJ��mol��1�٣��ڶ���ͼ�Ȼ�ѧ��Ӧ����ʽΪ2C(s)��O2(g)=2CO(g) ��H=��221.0kJ��mol��1�ڣ�ʯӢ�ͽ�̿��Ӧ�Ʊ��ֹ�ķ�Ӧ����ʽΪSiO2��2C=2CO��Si������ɢڣ��ٵó���SiO2(s)+2C(s)=Si(s)+2CO(g) H=+638.4kJ/mol����2�����⿼�黯ѧ�������̣���ɰ���к���SiO2����NaOH��Ӧ����Na2SiO3������II��X�м���ϡ���ᣬ����SiO32����2H��=H2SiO3������SiO32����2H����H2O=H4SiO4������Y�Ļ�ѧʽΪH2SiO3��H4SiO4���ڷ�ӦI�����ӷ���ʽΪSiO2��2OH��=SiO32����H2O���۸������̣�����SiO2+4Mg![]() Mg2Si+2MgO���ܼ�����鶼���ڷ��Ӿ��壬C��ԭ�Ӱ뾶С��Si��Ҳ����C��H������Si��H�����̣���̼Ԫ�صķǽ�����ǿ�ڹ�Ԫ�أ���˹�����ȶ������ڼ��飻��3��������������ԭ���ͻ�ѧƽ�ⳣ����A����Ͷ�ϱ���ͬʱ���¶�Խ�ߣ����ȹ����ת����Խ������������ԭ��������ӦΪ���ȷ�Ӧ����A����B�����Ͷ�ϱ�Ϊn(H2)/n(SiHCl3)������Ͷ�ϱȵ����࣬��H2�����ӣ�ƽ��������Ӧ�����ƶ��������ȹ����ת����������ͼ��B��ȷ��C����Ϊ����ӦΪ���ȷ�Ӧ���һ�ѧƽ�ⳣ�� �¶ȵ�Ӱ�죬��������¶ȣ�ƽ��������Ӧ�����ƶ�������ѧƽ�ⳣ������C��ȷ��D��������������ԭ��������ѹǿ��ƽ�����淴Ӧ�����ƶ������ȹ����ת���ʽ��ͣ���D����
Mg2Si+2MgO���ܼ�����鶼���ڷ��Ӿ��壬C��ԭ�Ӱ뾶С��Si��Ҳ����C��H������Si��H�����̣���̼Ԫ�صķǽ�����ǿ�ڹ�Ԫ�أ���˹�����ȶ������ڼ��飻��3��������������ԭ���ͻ�ѧƽ�ⳣ����A����Ͷ�ϱ���ͬʱ���¶�Խ�ߣ����ȹ����ת����Խ������������ԭ��������ӦΪ���ȷ�Ӧ����A����B�����Ͷ�ϱ�Ϊn(H2)/n(SiHCl3)������Ͷ�ϱȵ����࣬��H2�����ӣ�ƽ��������Ӧ�����ƶ��������ȹ����ת����������ͼ��B��ȷ��C����Ϊ����ӦΪ���ȷ�Ӧ���һ�ѧƽ�ⳣ�� �¶ȵ�Ӱ�죬��������¶ȣ�ƽ��������Ӧ�����ƶ�������ѧƽ�ⳣ������C��ȷ��D��������������ԭ��������ѹǿ��ƽ�����淴Ӧ�����ƶ������ȹ����ת���ʽ��ͣ���D����

 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�����Ŀ����֪���¶ȵ���570 0C ʱ����ԭ������ˮ������Ӧ�IJ�����FeO������570 0Cʱ������Fe3O4����ʦ����ͼ��ʾʵ��װ�ã�����˻�ԭ������ˮ������Ӧ����ʾʵ�顣
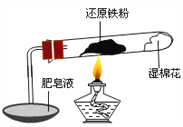
��ͬѧΪ̽��ʵ����Թ��ڵĹ��庬����Щ���ʣ�����������ʵ�飺
ʵ���� | ʵ����� | ʵ������ |
�� | ȡ������ɫ��ĩ�����Թ��У��������ᣬ�� | ��ɫ��ĩ���ܽ⣬��Һ��dz��ɫ�����������ݲ��� |
�� | ���Թ��еμӼ���KSCN��Һ���� | ��Һû�г���Ѫ��ɫ |
��������ʵ�飬����˵������ȷ���ǣ� ��
A. �Թ��ڵĹ���һ����������
B. �Թ��ڵĹ���һ��������Fe3O4
C. ����ȷ���Թ��ڵĹ���һ������FeO
D. ��ͨ�����Թ��ڹ��峹��ԭ��������������С�ķ�����ȷ���Ƿ���Fe3O4

