题目内容
已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推知ABn型分子是非极性分子的经验规律是( )
| A.分子中所有原子在同一平面内 |
| B.分子中不含氢原子 |
| C.在ABn分子中,A元素为最高正价 |
| D.在ABn型分子中,A原子最外层电子都已成键 |
D
解析

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列物质中不存在氢键的是
| A.水 | B.甲醇 | C.乙醇 | D.乙烷 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,
电子式如图所示: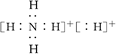 ,下列说法正确的是( )
,下列说法正确的是( )
| A.NH5属于离子化合物 |
| B.NH5属于共价化合物 |
| C.NH5只含有离子键 |
| D.NH5只含有共价键 |
常温下硫单质主要以S8形式存在,加热时S8会转化为S6、S4、S2等,当蒸气温度达到750°C时主要以S2形式存在,下列说法正确的是( )
| A.S8转化为S6、S4、S2属于物理变化 |
| B.不论哪种硫分子,完全燃烧时都生成SO2 |
| C.常温条件下单质硫为原子晶体 |
| D.把硫单质在空气中加热到750°C即得S2 |
关于氢键,下列说法正确的是( )
| A.每一个水分子内含有两个氢键 |
| B.冰、水和水蒸气中都存在氢键 |
| C.分子间形成的氢键使物质的熔点和沸点升高 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是( )
| A | B | C | D |
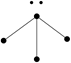 |  | 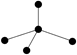 |  |
| NH3 | C2H2 | CCl4 | CO2 |
离子键的强弱主要决定于离子的半径和离子电荷数。一般规律是:离子半径越小,离子电荷数越大,则离子键越强。K2O、MgO、CaO三种物质中离子键由强到弱的顺序是( )
| A.K2O、MgO、CaO | B.MgO、K2O、CaO |
| C.MgO、CaO、K2O | D.CaO、MgO、K2O |
下列有关σ键和π键的说法错误的是 ( )
| A.含有π键的分子在反应时,π键比σ键易断裂 |
| B.当原子形成分子时,一定形成σ键,可能形成π键 |
| C.有些原子在与其他原子形成分子时,只能形成σ键,不能形成π键 |
| D.在分子中,化学键可能只有π键而没有σ键 |