题目内容
下列物质中不存在氢键的是
| A.水 | B.甲醇 | C.乙醇 | D.乙烷 |
D
解析试题分析:由于C原子的电负性小,因此在乙烷的分子之间不存在氢键;而在水、甲醇及乙醇的分子内由于都含有电负性大,原子半径又较小的O原子,所以分子与分子之间都存在氢键。因此选项为D。
考点:考查氢键的形成及判断的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质既含有离子键又含有共价键的是
| A.H2O | B.Na2O | C.NH4Cl | D.N2 |
下列物质中,化学键类型完全相同的是
| A.CaBr2与HCl | B.MgCl2与Na2S |
| C.KOH与NaCl | D.H2O与NaCl |
下列物质只含离子键的是
| A.H2O | B.Na2O | C.NaOH | D.HCl |
下列物质的立体结构与NH3相同的是( )
| A.H3O+ | B.H2O | C.CH4 | D.CO2 |
下列用电子式表示的形成过程正确的是( )
A.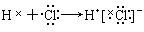 |
B.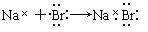 |
C.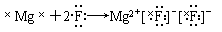 |
D. |
下列说法正确的是 ( )
| A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。 |
| B.HF、HCl、HBr、HI的熔点沸点依次升高。 |
| C.乙醇分子与水分子之间只存在范德华力。 |
| D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
关于离子键、共价键的各种叙述中正确的是( )
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.由不同元素组成的多原子分子里,一定只存在极性键 |
| D.共价化合物分子中,一定不存在离子键 |
已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推知ABn型分子是非极性分子的经验规律是( )
| A.分子中所有原子在同一平面内 |
| B.分子中不含氢原子 |
| C.在ABn分子中,A元素为最高正价 |
| D.在ABn型分子中,A原子最外层电子都已成键 |