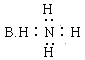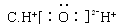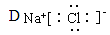题目内容
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,
电子式如图所示: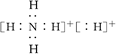 ,下列说法正确的是( )
,下列说法正确的是( )
| A.NH5属于离子化合物 |
| B.NH5属于共价化合物 |
| C.NH5只含有离子键 |
| D.NH5只含有共价键 |
A
解析

练习册系列答案
相关题目
下列物质中,化学键类型完全相同的是
| A.CaBr2与HCl | B.MgCl2与Na2S |
| C.KOH与NaCl | D.H2O与NaCl |
下列说法正确的是 ( )
| A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。 |
| B.HF、HCl、HBr、HI的熔点沸点依次升高。 |
| C.乙醇分子与水分子之间只存在范德华力。 |
| D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
关于离子键、共价键的各种叙述中正确的是( )
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.由不同元素组成的多原子分子里,一定只存在极性键 |
| D.共价化合物分子中,一定不存在离子键 |
下列共价化合物的电子式正确的是( )。
A.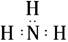 (NH3) (NH3) | B.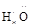 ∶∶ ∶∶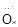 H(H2O2) H(H2O2) |
C.∶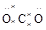 ∶(CO2) ∶(CO2) | D.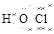 (HClO) (HClO) |
以下有关杂化轨道的说法中错误的是( )
| A.ⅠA族元素成键时不可能有杂化轨道 |
| B.杂化轨道既可能形成σ键,也可能形成π键 |
| C.孤对电子有可能参加杂化 |
| D.s轨道和p轨道杂化不可能有sp4出现 |
已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推知ABn型分子是非极性分子的经验规律是( )
| A.分子中所有原子在同一平面内 |
| B.分子中不含氢原子 |
| C.在ABn分子中,A元素为最高正价 |
| D.在ABn型分子中,A原子最外层电子都已成键 |
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )。
| A.sp,范德华力 | B.sp2,范德华力 |
| C.sp2,氢键 | D.sp3,氢键 |