题目内容
将10.7g氯化铵固体与足量熟石灰混合加热,使之充分反应。
(1)写出反应的化学方程式: 。
(2)生成的氨气在标准状况下的体积是 L。
(3)若将这些氨气溶于水配成500mL氨水,该氨水的物质的量浓度是 mol·L-1。
(4)在400℃左右且有催化剂存在的情况下,用氨可以把一氧化氮还原成氮气,方程式为:4NH3+6NO=5N2+6H2O,此反应中氧化产物与还原产物的物质的量之比为 。
(1)2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑(2)4.48L(3)0.4mol/L(4)2︰3
CaCl2 + 2H2O + 2NH3↑(2)4.48L(3)0.4mol/L(4)2︰3
解析试题分析:(1)在实验室中是利用铵盐与碱共热来制取氨气的。氯化铵固体与足量熟石灰混合加热的化学方程式为2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑。n(NH4Cl)= 10.7g ÷53.5g/mol=0.2mol.所以产生的氨气的物质的量为0.2mol,在标准状况下的体积为V="n·Vm=0.2mol×" 22.4mol/L="4.48L." C="n/V=" 0.2mol ÷0.5L=0.4mol/L;(4)在反应 4NH3+6NO=5N2+6H2O中,NH3中的N的化合价为-3价,反应后变为N2中的0价,化合价升高,失去电子,作还原剂,变为氧化产物;NO中的N化合价为+2价,反应后变为N2中的0价,化合价降低,得到电子,作氧化剂,变为还原产物。反应中氧化产物与还原产物的物质的量之比为4:6=2:3.
CaCl2 + 2H2O + 2NH3↑。n(NH4Cl)= 10.7g ÷53.5g/mol=0.2mol.所以产生的氨气的物质的量为0.2mol,在标准状况下的体积为V="n·Vm=0.2mol×" 22.4mol/L="4.48L." C="n/V=" 0.2mol ÷0.5L=0.4mol/L;(4)在反应 4NH3+6NO=5N2+6H2O中,NH3中的N的化合价为-3价,反应后变为N2中的0价,化合价升高,失去电子,作还原剂,变为氧化产物;NO中的N化合价为+2价,反应后变为N2中的0价,化合价降低,得到电子,作氧化剂,变为还原产物。反应中氧化产物与还原产物的物质的量之比为4:6=2:3.
考点:考查氨气的实验室制备原理、化学性质、溶解性、氨气的体积及配制的溶液的浓度的计算等知识。

氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)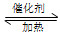 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的
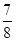 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。

③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解 可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。