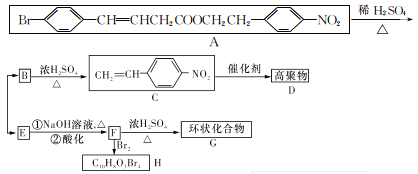
题目内容
【题目】四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如下图所示:

有关信息如下:
①反应原理:TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g)。
TiCl4(g)+CO2(g)。
②反应条件:无水无氧且加热。
③有关物质性质如下表所示:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F中有氮气生成,该反应的化学方程式为_______________________。
(2)实验装置依次连接的顺序为F→B→______。
(3)实验开始前首先点燃____处(填“D”或“F”)酒精灯,目的是______________。
(4)E装置不能换成B装置,理由是______________。
(5)欲分离装置C中的液态混合物,所采用操作方法的名称是______________。
(6)TiCl4是制取航天航空工业材料钛合金的重要原料。某钛合金含有的元素还有Al和Si等。已知在常温下,钛是一种耐强酸、强碱的金属,请设计实验检验其中的Si元素________________。
【答案】 NaNO2+NH4Cl![]() N2↑+NaCl+2H2O ADCE F 排除装置中的空气,保证反应在无水无氧环境下进行 B装置可以吸收水,但不能阻止空气中的氧气进入。不能保证反应在无氧环境下进行 蒸馏 取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中含有Si元素(合理答案均可给分)
N2↑+NaCl+2H2O ADCE F 排除装置中的空气,保证反应在无水无氧环境下进行 B装置可以吸收水,但不能阻止空气中的氧气进入。不能保证反应在无氧环境下进行 蒸馏 取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中含有Si元素(合理答案均可给分)
【解析】 (1)F中的反应物为NaNO2、NH4Cl,在加热条件下生成氮气,属于归中型氧化还原反应:NaNO2+NH4Cl![]() N2↑+NaCl+2H2O;(2)以TiO2和CCl4为原料在实验室制取液态TiCl4,需要无水无氧且加热条件下进行,所以要先通干燥氮气,根据表格中物理数据,实验装置依次连接的顺序为F→B→_A_→D→C→ E;(3)为保证反应在无水无氧环境下进行,需要排除装置中的空气, 因此应先在F处加热,通一段时间的氮气;(4)B装置中浓硫酸仅作干燥剂,吸收水份,而E中的NaHSO3能吸收空气中的氧气,阻止空气中氧气进入合成流程中,保证反应在无氧干燥环境下进行,因此,这两个装置不能互换;(5)C中的有生成的TiCl4和过量的CCl4,由于两者沸点相差较大,可以用蒸馏法进行分离;(6)钛是一种耐强酸强碱的金属,而硅能溶于碱生成硅酸盐,取少量合金样品于试管中,滴加过量NaOH溶液,振荡,Si+2NaOH+H2O=Na2SiO3+2H2↑,静置后取上层清液,再逐滴滴入稀盐酸至过量,Na2SiO3+2HCl=H2SiO3↓+2NaCl,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si。
N2↑+NaCl+2H2O;(2)以TiO2和CCl4为原料在实验室制取液态TiCl4,需要无水无氧且加热条件下进行,所以要先通干燥氮气,根据表格中物理数据,实验装置依次连接的顺序为F→B→_A_→D→C→ E;(3)为保证反应在无水无氧环境下进行,需要排除装置中的空气, 因此应先在F处加热,通一段时间的氮气;(4)B装置中浓硫酸仅作干燥剂,吸收水份,而E中的NaHSO3能吸收空气中的氧气,阻止空气中氧气进入合成流程中,保证反应在无氧干燥环境下进行,因此,这两个装置不能互换;(5)C中的有生成的TiCl4和过量的CCl4,由于两者沸点相差较大,可以用蒸馏法进行分离;(6)钛是一种耐强酸强碱的金属,而硅能溶于碱生成硅酸盐,取少量合金样品于试管中,滴加过量NaOH溶液,振荡,Si+2NaOH+H2O=Na2SiO3+2H2↑,静置后取上层清液,再逐滴滴入稀盐酸至过量,Na2SiO3+2HCl=H2SiO3↓+2NaCl,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si。

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案