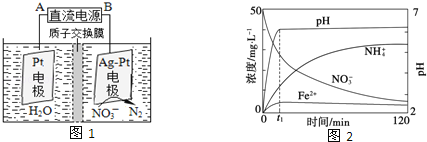
��Ŀ����
����Ŀ�������仯������;�dz��㷺�����ï�����������ȼ�����Ӽ�������������ֱ����������մɴ������û����ϩ�Ʒ��Ʊ���ï��(��ͼ)��ԭ��Ϊ��C5H6+NaOH��C5H5Na+H2O��2C5H5Na+FeCl2��(C5H5)2Fe+2NaCl��

(1)��Ԫ�صĻ�̬�۵����Ų�ʽΪ________________��
(2)��̬Naԭ���У��������ռ�ݵ�����ܼ��ķ�����________��ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ________��Na��K����ͬһ���壬������Na���۵�Ƚ���K�ߣ�ԭ����________________________________________��
(3)(C5H5)2Fe��������![]() �е���������Ϊ____���������еĴ��������÷�����mn��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ��66)����
�е���������Ϊ____���������еĴ��������÷�����mn��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ��66)����![]() �еĴ�����Ӧ��ʾΪ________________��
�еĴ�����Ӧ��ʾΪ________________��
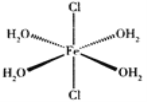
(4)�ö��Ұ����ϳɶ�ï����ԭ����(C2H5)2NH��FeCl2��4H2O��C5H6��FeCl2��4H2O��һ��������ṹ��ͼ��ʾ��Fe2+������֮���γɵĻ�ѧ����Ϊ____________��
(5)�����ȵľ����ṹ����ͼ��ʾ��
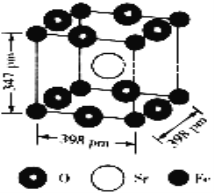
�پ����о��������������ԭ�ӵľ���Ϊ________________cm(�г��������ʽ����)��
�ڸþ�����ܶ�Ϊ_______________________g��cm-3(�г��������ʽ����)��(���ԭ��������Fe:56 Sr:88 O:16)
���𰸡� 3d64s2 3s ���� Na��ԭ�Ӱ뾶��С�Ҽ۵�������K��ͬ����������ǿ 10 ![]() ��λ��
��� ![]()
![]()
��������(1) ����Ԫ�صļ۵��Ӳ������������ӣ��������Ӽ�ijЩԪ�صĵ������������Ҳ�ɳ�Ϊ�۵��ӣ� �������ĵ����Ų�ʽ1s22s22p63s23p63d64s2��֪Fe�ļ۵����Ų�ʽΪ��3d64s2��
(2)Na�ĵ����Ų�ʽΪ1s22s22p63s1�����ݵ��ӵĹ���ԭ����֪Naԭ����3s�ܼ���������ߣ�s�����������νṹ��Na��ԭ�Ӱ뾶�ȼص�ԭ�Ӱ뾶С���۵�������K��ͬ������Na�Ľ�������ǿ���۵�ߡ��ʴ�Ϊ�� 3s �� ���Ρ� Na��ԭ�Ӱ뾶��С�Ҽ۵�������K��ͬ����������ǿ��
(3) ![]() �����к���3��̼̼������3������������2��̼̼˫����ÿ��˫���к���1����������2���������������л�����5��̼�ⵥ����5�������������ܹ�����3+2+5=10��������
�����к���3��̼̼������3������������2��̼̼˫����ÿ��˫���к���1����������2���������������л�����5��̼�ⵥ����5�������������ܹ�����3+2+5=10��������![]() ������ԭ����5����ÿ��̼ԭ����һ�������ӣ�5��̼ԭ���ܹ���5�������ӣ��Ҹ����ӵõ���һ�����ӣ����ܹ���6�����ӣ����Դ��������Ա�ʾΪ
������ԭ����5����ÿ��̼ԭ����һ�������ӣ�5��̼ԭ���ܹ���5�������ӣ��Ҹ����ӵõ���һ�����ӣ����ܹ���6�����ӣ����Դ��������Ա�ʾΪ![]() ��
��
(4) FeCl2��4H2O����ԭ��ΪFe2+�������Ų�ʽΪ1s22s22p63s23p63d6���пչ��������ΪH2O��O�йµ��Ӷԣ�����Fe2+������֮���γɵĻ�ѧ������λ����
(5) �ٺ�����ͬһƽ���ϴ�ֱ���������ϵ�Oԭ�ӵľ�����̣���ͼ��ɫԲȦ��������ԭ�� ��������̾���Ϊd���߳�Ϊa=398pm=398��10-10cm�����ݼ���֪ʶ֪����Oԭ����̾���d2=2�� (a/2)2�����d=
��������̾���Ϊd���߳�Ϊa=398pm=398��10-10cm�����ݼ���֪ʶ֪����Oԭ����̾���d2=2�� (a/2)2�����d=![]() �� ��һ��������ʵ�ʺ��е�Srԭ��Ϊ1����Feԭ��Ϊ8��1/8=1����Oԭ��Ϊ8��1/4=2���������仯ѧʽΪSrFeO2��1�������к��е�SrFeO2����Ϊ1��������=��176/NA��g�����������Ϊ(398��10-10)2��347��10-10cm3�������ܶ�=��176/NA��g��[(398��10-10)2��347��10-10]cm3=
�� ��һ��������ʵ�ʺ��е�Srԭ��Ϊ1����Feԭ��Ϊ8��1/8=1����Oԭ��Ϊ8��1/4=2���������仯ѧʽΪSrFeO2��1�������к��е�SrFeO2����Ϊ1��������=��176/NA��g�����������Ϊ(398��10-10)2��347��10-10cm3�������ܶ�=��176/NA��g��[(398��10-10)2��347��10-10]cm3=![]() g��cm-3��
g��cm-3��

����Ŀ�������й����ʵ�ʵ�������������������ȷ������ ��
ѡ�� | ʵ����������� | ���� |
A | �ò�˿պȡij����Һ�ھƾ������������գ��������ɫ������ɫ�ܲ����� | ������Һ��һ�����м�Ԫ�أ����ܺ���Ԫ�� |
B | ��ij��ɫ��Һ��ͨ�������CO2���壬�а�ɫ�������� | ����Һ��һ������SiO32�C |
C | ��Ʒ����Һ��ͨ��ij�������Һ��ɫ | ������һ����SO2 |
D | ��NaOH��Һ�еμ�MgCl2��Һ��������ɫ�����������μ�FeCl3��Һ�������ɫ���� | Fe(OH)3���ܽ��С��Mg(OH)2���ܽ�� |
A. A B. B C. C D. D
����Ŀ�����Ȼ���(TiCl4)�����������Ѽ��仯�������Ҫ�м��塣�����£����Ȼ���Ϊ��ɫҺ�塣ij��ѧ��ȤС��ͬѧ��TiO2��CCl4Ϊԭ����ʵ������ȡҺ̬TiCl4��װ������ͼ��ʾ:
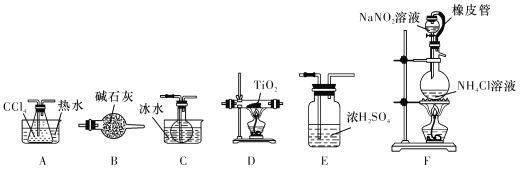
�й���Ϣ����:
�ٷ�Ӧԭ��:TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g)��
TiCl4(g)+CO2(g)��
�ڷ�Ӧ��������ˮ�����Ҽ��ȡ�
���й������������±���ʾ:
���� | �۵�/�� | �е�/�� | ���� |
CCl4 | -23 | 76 | ��TiCl4���� |
TiCl4 | -25 | 136 | ����ʪ������������ |
��ش���������:
��1��װ��F���е������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ_______________________��
��2��ʵ��װ���������ӵ�˳��ΪF��B��______��
��3��ʵ�鿪ʼǰ���ȵ�ȼ____��(����D������F��)�ƾ��ƣ�Ŀ����______________��
��4��Eװ�ò��ܻ���Bװ�ã�������______________��
��5��������װ��C�е�Һ̬���������ò���������������______________��
��6��TiCl4����ȡ���캽�չ�ҵ�����ѺϽ����Ҫԭ�ϡ�ij�ѺϽ��е�Ԫ�ػ���Al��Si�ȡ���֪�ڳ����£�����һ����ǿ�ᡢǿ��Ľ����������ʵ��������е�SiԪ��________________��
����Ŀ��A,B,CΪ������Ԫ�أ������ڱ���������λ�������ʾ��
A | C | |
B |
A��C��Ԫ�ص�ԭ�Ӻ��������֮�͵���Bԭ�ӵ���������
��1��д��B,CԪ�ص������� ��
��2��Bλ��Ԫ�����ڱ��е����ڵ��壮
��3����ʯīΪ�缫�����BԪ�ص�����������ˮ�����ˮ��Һ������·��ת��0.4mol����ʱ���������ռ����IJ����� �� ����Ϊg�������ܷ�Ӧ����ʽΪ��
��4��д��A����̬�⻯����������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽ ��