题目内容
【题目】反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的速率可表示为( )
A.v(NH3)=0.01 molL﹣1s﹣1
B.v(O2)=0.001 molL﹣1s﹣1
C.v(NO)=0.001 molL﹣1s﹣1
D.v(H2O)=0.045 molL﹣1s﹣1
【答案】C
【解析】解:在体积10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol. 则v(H2O)= ![]() =0.0015molL﹣1s﹣1 ,
=0.0015molL﹣1s﹣1 ,
A.速率之比等于化学计量数之比,所以v(NH3)= ![]() ×0.0015molL﹣1s﹣1=0.0010molL﹣1s﹣1 , 故A错误;
×0.0015molL﹣1s﹣1=0.0010molL﹣1s﹣1 , 故A错误;
B.速率之比等于化学计量数之比,所以v(O2)= ![]() ×0.0015molL﹣1s﹣1=0.00125molL﹣1s﹣1 , 故B错误;
×0.0015molL﹣1s﹣1=0.00125molL﹣1s﹣1 , 故B错误;
C.速率之比等于化学计量数之比,所以v(NO)= ![]() ×0.0015molL﹣1s﹣1=0.0010molL﹣1s﹣1 , 故C正确;
×0.0015molL﹣1s﹣1=0.0010molL﹣1s﹣1 , 故C正确;
D.v(H2O)= ![]() =0.0015molL﹣1s﹣1 , 故D错误.
=0.0015molL﹣1s﹣1 , 故D错误.
故选:C.
【考点精析】根据题目的已知条件,利用反应速率的定量表示方法的相关知识可以得到问题的答案,需要掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体。某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如下图所示:
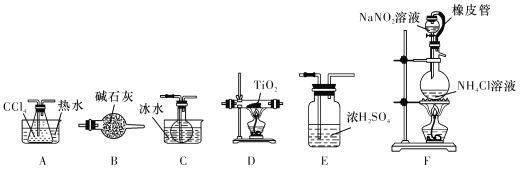
有关信息如下:
①反应原理:TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g)。
TiCl4(g)+CO2(g)。
②反应条件:无水无氧且加热。
③有关物质性质如下表所示:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)装置F中有氮气生成,该反应的化学方程式为_______________________。
(2)实验装置依次连接的顺序为F→B→______。
(3)实验开始前首先点燃____处(填“D”或“F”)酒精灯,目的是______________。
(4)E装置不能换成B装置,理由是______________。
(5)欲分离装置C中的液态混合物,所采用操作方法的名称是______________。
(6)TiCl4是制取航天航空工业材料钛合金的重要原料。某钛合金含有的元素还有Al和Si等。已知在常温下,钛是一种耐强酸、强碱的金属,请设计实验检验其中的Si元素________________。