题目内容
18.丙酮和苯酚都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下: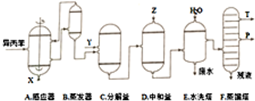
①
 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$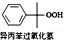 △H=-116kJ.mol-1
△H=-116kJ.mol-1②
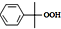 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$ △H=-253kJ.mol-1
△H=-253kJ.mol-1相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOHb.CaCO3c.NaHCO3d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
分析 用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在反应器A中发生氧化反应生成 ,在蒸发器中分离出
,在蒸发器中分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在分解釜中在浓硫酸作催化剂条件下分解得到
在分解釜中在浓硫酸作催化剂条件下分解得到 、
、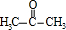 ,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚.
,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚.
(1)由上述分析可知,反应①在A中发生,反应②在C中发生;
(2)反应②的△H<0,为放热反应,含有过氧化物,温度过高,容易发生爆炸;
(3)在反应器A发生信息中的反应①,应通入氧气或空气;
(4)浓硫酸起催化剂作用,浓硫酸腐蚀性强,会腐蚀设备;
(5)加入的Z中和硫酸,且不能与苯酚反应;
(6)沸点越低越先蒸出,处于蒸馏塔的上部;
(7)由异丙苯最终得到苯酚和丙酮,原子利用率高.
解答 解:用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在反应器A中发生氧化反应生成 ,在蒸发器中分离出
,在蒸发器中分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在分解釜中在浓硫酸作催化剂条件下分解得到
在分解釜中在浓硫酸作催化剂条件下分解得到 、
、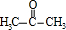 ,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚.
,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚.
(1)由上述分析可知,反应①在反应器中发生,即A装置,反应②在分解釜中进行,即C装置,
故答案为:A;C;
(2)反应②的△H<0,为放热反应,有过氧化物存在,温度过高会导致爆炸,反应温度控制在50-60℃,
故答案为:放热;温度过高会导致爆炸;
(3)在反应器A发生信息中的反应①,故需要氧气或空气,
故答案为:氧气或空气;
(4) 在浓硫酸作条件下分解得到
在浓硫酸作条件下分解得到 、
、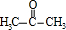 ,浓硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备,
,浓硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备,
故答案为:催化剂;腐蚀设备;
(5)加入Z的目的是中和硫酸,且不能与苯酚反应,
a.NaOH能与硫酸、苯酚反应,故不选;
b.CaCO3为固体,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反应,故b不选;
c.NaHCO3能与硫酸反应,不与苯酚反应,故c选;
d.CaO能与苯酚反应,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反应,故d不选;
故选:c;
(6)由于丙酮的沸点低于苯酚,沸点越低越先蒸出,处于蒸馏塔的上部,则T为丙酮、P为苯酚,
故答案为:丙酮;苯酚;丙酮的沸点低于苯酚;
(7)由异丙苯最终得到苯酚和丙酮,整个过程原子利用率高,故答案为:原子利用率高.
点评 本题考查有机物的制备实验方案,涉及对化学工艺流程、装置及试剂的分析评价等,关键是根据实验目的与给予的反应信息理解工艺流程原理,是对学生综合能力的考查,难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| B. |  既可表示18O2-,也可以表示16O2- 既可表示18O2-,也可以表示16O2- | |
| C. | Fe-2e-═Fe2+可表示钢铁析氢腐蚀和吸氧腐蚀的正极反应 | |
| D. | 乙醇分子的比例模型: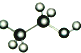 |
 ,它的主链上含有( )个碳原子.
,它的主链上含有( )个碳原子.| A. | 四个 | B. | 五个 | C. | 六个 | D. | 七个 |
| A. | vA=0.005 mol•(L•min)-1 | B. | vC=0.025mol•(L•min)-1 | ||
| C. | vB=0.150mol•(L•min)-1 | D. | vD=0.015mol•(L•min)-1 |
| A. | C3H6O2 | B. | C2H6O | C. | C2H4O | D. | CH4O |
| A. | CH3CH2COOCH(CH3)2 | B. | CH3CH2COOCH2CH=CH2 | ||
| C. | (CH3)2CHCOOCH2CH(CH3)2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |
| A. | 铝片加入到少量浓烧碱溶液中:Al+3OH-═Al(OH)3 | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al++6OH-+3SO42-+3Ba2+═2Al(OH)3↓+3BaSO4↓ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O | |
| D. | 用惰性电极电解 饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ |
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(CO2)=0.77mol/(L•s).
(3)在该温度下,反应的平衡常数K=3.33×1036.
(4)假设在密闭容器中发生上述反应,达到平衡时,下列措施既不会提高成本,又能提高SO2转化率的是BC.
A.选用更有效的催化剂 B.提高n(CO):n(SO2)投料比
C.降低反应体系的温度 D.缩小容器的体积
(5)为了分别验证不同催化剂、温度、浓度对化学反应速率的影响规律,某同学设计了四组实验使反应速率依次增大,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
②研究表明:Fe2O3的催化效果好于Cr2O3.请在答题卷相应位置画出上表中的四个实验条件下混合气体中SO2浓度随时间变化的趋势曲线图,并标明各实验编号.

