题目内容
6.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+S(l)为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(CO2)=0.77mol/(L•s).
(3)在该温度下,反应的平衡常数K=3.33×1036.
(4)假设在密闭容器中发生上述反应,达到平衡时,下列措施既不会提高成本,又能提高SO2转化率的是BC.
A.选用更有效的催化剂 B.提高n(CO):n(SO2)投料比
C.降低反应体系的温度 D.缩小容器的体积
(5)为了分别验证不同催化剂、温度、浓度对化学反应速率的影响规律,某同学设计了四组实验使反应速率依次增大,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
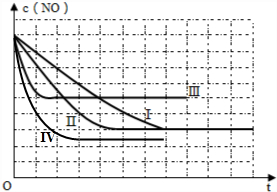
②研究表明:Fe2O3的催化效果好于Cr2O3.请在答题卷相应位置画出上表中的四个实验条件下混合气体中SO2浓度随时间变化的趋势曲线图,并标明各实验编号.
分析 (1)正反应为熵减的反应,△G=△H-T△S<0时反应自发进行;
(2)根据v=$\frac{△c}{△t}$计算v(CO),再根据速率之比等于化学计量数之比计算v(CO2);
(3)由表中数据可知,3s时处于平衡状态,CO浓度变化量为2mol/L,则平衡时二氧化碳浓度为2mol/L,代入平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})}{c(S{O}_{2})×{c}^{2}(CO)}$计算;
(4)A.选用更有效的催化剂不影响平衡移动;
B.提高n(CO):n(SO2)投料比可以提高SO2转化率,不会提高成本;
C.由(1)中可知,正反应为放热反应,降低反应体系的温度,平衡正向移动,不会提高成本;
D.缩小容器的体积,需要提供能量,会提高成本;
(5)①实验目的是验证不同催化剂、温度、浓度对化学反应速率的影响规律,实验I、Ⅱ中催化剂不同,实验I、Ⅳ中CO初始浓度不同,实验I、Ⅲ中温度不同,其它条件均相同;
②实验I、Ⅱ中Fe2O3的催化效果好于Cr2O3,到达平衡时间Ⅰ>Ⅱ,不影响平衡移动,平衡时二氧化硫浓度相等;
实验I、Ⅳ中实验Ⅳ的CO初始浓度大,到达平衡时间Ⅰ>Ⅳ,Ⅳ中二氧化硫的转化率大,平衡时二氧化硫的浓度Ⅳ<Ⅰ;
实验I、Ⅲ中实Ⅲ的温度大,到达平衡时间Ⅰ>Ⅲ,正反应为放热反应,平衡逆向移动,Ⅲ中二氧化硫的转化率小,平衡时二氧化硫的浓度Ⅲ>Ⅰ.
解答 解:(1)正反应为熵减的反应,△S<0,反应自发进行,则△G=△H-T△S<0,故△H<0,
故答案为:<;
(2)由表中的数据可知2s内CO浓度的变化量为(4-2.46)mol/L=1.54mol/L,则v(CO)=$\frac{1.54mol/L}{2S}$=0.77mol/(L•s),化学反应速率之比等于化学计量数之比,则v(CO2)=v(CO)=0.77mol/(L•s),
故答案为:0.77mol/(L•s);
(3)由表中数据可知,3s时处于平衡状态,平衡时二氧化硫浓度为3.00×10-37mol/L,CO浓度为2mol/L,CO浓度变化量为(4-2)mol/L=2mol/L,则平衡时二氧化碳浓度为2mol/L,则平衡常数K=$\frac{{c}^{2}(C{O}_{2})}{c(S{O}_{2})×{c}^{2}(CO)}$=$\frac{{2}^{2}}{3×1{0}^{-37}×{2}^{2}}$=3.33×1036,
故答案为:3.33×1036;
(4)A.选用更有效的催化剂不影响平衡移动,不能提高SO2转化率,故A错误;
B.提高n(CO):n(SO2)投料比可以提高SO2转化率,不会提高成本,故B正确;
C.由(1)中可知,正反应为放热反应,降低反应体系的温度,平衡正向移动,提高SO2转化率,不会提高成本,故C正确;
D.缩小容器的体积,平衡正向移动,可以提高SO2转化率,但需要提供能量,会提高成本,故D错误,
故选:BC;
(5)①实验目的是验证不同催化剂、温度、浓度对化学反应速率的影响规律,实验I、Ⅱ中催化剂不同,实验I、Ⅳ中CO初始浓度不同,实验I、Ⅲ中温度不同,其它条件均相同,则:
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | 260 | 1.00 | 3.00 | Fe2O3 |
| Ⅲ | 380 | 1.00 | 3.00 | Cr2O3 |
| Ⅳ | 260 | 1.00 | 4.00 | Cr2O3 |
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | ||||
| Ⅱ | 260 | 1.00 | 3.00 | |
| Ⅲ | 1.00 | 3.00 | Cr2O3 | |
| Ⅳ | 260 | 1.00 | Cr2O3 |
实验I、Ⅳ中实验Ⅳ的CO初始浓度大,到达平衡时间Ⅰ>Ⅳ,Ⅳ中二氧化硫的转化率大,平衡时二氧化硫的浓度Ⅳ<Ⅰ;
实验I、Ⅲ中实Ⅲ的温度大,到达平衡时间Ⅰ>Ⅲ,正反应为放热反应,平衡逆向移动,Ⅲ中二氧化硫的转化率小,平衡时二氧化硫的浓度Ⅲ>Ⅰ,
表中的四个实验条件下混合气体中SO2浓度随时间变化的趋势曲线图:
 ,
,故答案为:
 .
.点评 本题考查化学平衡计算、化学平衡影响因素、探究化学反应速率影响因素等,(5)中注意利用控制变量法分析解答,作图中注意到达平衡时间、平衡时二氧化硫的浓度,难度中等.

①
 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$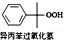 △H=-116kJ.mol-1
△H=-116kJ.mol-1②
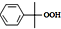 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$ △H=-253kJ.mol-1
△H=-253kJ.mol-1相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
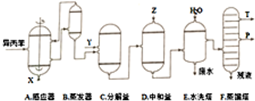
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOHb.CaCO3c.NaHCO3d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
| A. | 反应①、②、③都是氧化还原反应 | |
| B. | 反应①中H2O2被还原 | |
| C. | 氧化性:KMnO4>O2 | |
| D. | 每生成1mol F2,上述反应共转移2mol电子 |
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 | |
| D. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
(1)工业上可用CO2和H2反应合成甲醇,已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-676kJ•mol-1
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示合成甲醇反应的能量变化示意图中正确的是a(填字母).
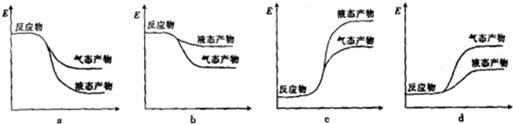
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•l-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>(填“<”“>”或“=”)7,原因是HCOO-+H2O?+HCOOH+OH-(用离子方程式表示).
| A. | 电能是二级能源 | B. | 水力是二级能源 | ||
| C. | 天然气是二级能源 | D. | 焦炉气是一级能源 |

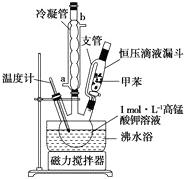 苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下:
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$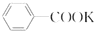 +KOH+2MnO2+H2O
+KOH+2MnO2+H2O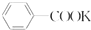 +HCl→
+HCl→ +KCl
+KCl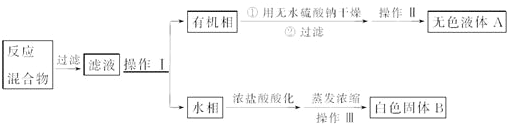
 的合成路线如图(部分反应条件省略)
的合成路线如图(部分反应条件省略)
 (注明反应的条件).
(注明反应的条件). .
.