题目内容
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.![]() 时
时![]() ,则该温度下
,则该温度下![]() 饱和溶液中含有
饱和溶液中含有![]() 个
个![]()
B.铅蓄电池放电时负极净增质量比正极净增质量多![]() 时,转移电子数为
时,转移电子数为![]()
C.![]() 溶于水,溶液中
溶于水,溶液中![]() 、
、![]() 、
、![]() 的总数为
的总数为![]()
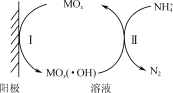
D.![]() 叠氮化铵
叠氮化铵![]() 发生爆炸
发生爆炸![]()
![]()
![]() 。当转移
。当转移![]() 个电子时,产生
个电子时,产生![]() 标准状况
标准状况![]() 混合气体
混合气体
【答案】B
【解析】
A.该选项没有提供体积,没法计算个数,故A错误;
B.铅蓄电池放电时,正极是二氧化铅得电子变成硫酸铅,负极是铅失电子变成硫酸铅,当转移2摩尔电子时负极净增质量比正极净增质量多32g,则当负极净增质量比正极净增质量多16g时,转移电子数为![]() ,故B正确;
,故B正确;
C.二氧化硫溶于水是一个可逆反应,根据原子守恒得![]() 、
、![]() 、
、![]() 的总数小于
的总数小于![]() ,故C错误;
,故C错误;
D.![]()
![]()
![]() 中,氢化合价降低,氮化合价升高,
中,氢化合价降低,氮化合价升高,![]() 中氮
中氮![]() 价,
价,![]() 中氮
中氮![]() 价,都升为0价,当转移
价,都升为0价,当转移![]() 个电子时,产生
个电子时,产生![]() 标准状况
标准状况![]() 混合气体,故D错误。
混合气体,故D错误。
故选B。

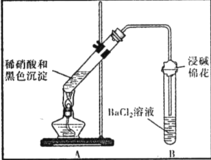
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为______________。
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是______________。
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明黑色沉淀具有_________性。 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:__________。
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全,则混合物中Cu2S 的质量分数为____________________。
【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )

Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D