题目内容
【题目】常温下,下列关于pH=3的HF溶液的叙述正确的是( )
A.该溶液中由H2O电离出的c(H+)=1.0×10-3 mol·L-1
B.与等体积pH=11的NaOH溶液混合,所得溶液呈中性
C.该溶液中离子浓度大小关系:c(H+)>c(F-)>c(OH-)
D.滴加NaOH溶液至c(F-)=c(Na+)时,溶液pH=7
【答案】CD
【解析】
A. HF电离出的H+抑制了水的电离;
B. HF过量,与等体积pH=11的NaOH溶液混合,所得溶液呈酸性;
C.H+除了来自HF电离,还来自水的电离,因此c(H+)>c(F-);
D.根据电荷守恒进行分析。
A. pH=3的HF溶液中,c(H+)=10-3mol/L,电离出的H+抑制了水的电离,溶液中OH-来自水的电离,则由水电离出的c(OH-)=![]() )=
)=![]() =10-11mol/L,A项错误;
=10-11mol/L,A项错误;
B. pH=3的HF溶液与等体积pH=11的NaOH溶液混合,HF为弱酸,混合液中HF过量,反应后所得溶液呈酸性,B项错误;
C. H+除了来自HF电离,还来自水的电离,因此c(H+)>c(F-),溶液中离子浓度的大小关系为:c(H+)>c(F-)>c(OH-),C项正确
D. 根据电荷守恒有c(H+)+ c(Na+)= c(OH-)+ c(F-),滴加NaOH溶液至c(F-)=c(Na+)时可得c(H+)= c(OH-),溶液呈中性,常温下溶液pH=7,D项正确;
答案选CD。

【题目】甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g) ![]() CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
C(s) | H2O(g) | H2(g) | |||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
下列说法正确的是( )
A.T1<T2B.乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol
C.混合气体的密度始终保持不变D.K2=1.35
【题目】钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。
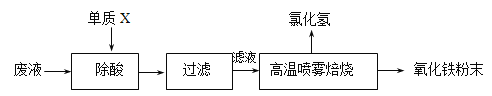
(1)单质X的化学式是___________。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为:_____________________________________________________________________。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3molL-1H2SO4、0.1 molL-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
操作步骤 | 预期现象和结论 |
步骤1.取少量样品于试管中,_______________ | 样品全部溶解,得到澄清的溶液。 |
步骤2.___________________ | __________________ |
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体___升(标准状况),即可得到36.5%的浓盐酸(相对原子质量 Cl 35.5 H 1)。