题目内容
下列说法或解释不正确的是
A.等物质的量浓度的下列溶液中,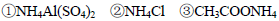
 由大到小的顺序是
由大到小的顺序是
B.室温下,向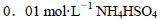 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性: 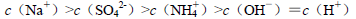

在任何温度下都能自发进行
C
解析试题分析:A、设溶液均为1mol/L物质的量浓度的溶液,①硫酸铝铵完全电离,产生的离子进行较弱的双水解生产氨水和氢氧化铝②NH4Cl在水中完全电离,而铵根离子,少量水解生成氨水③醋酸铵是强电解质,其中的铵根离子和醋酸根离子在溶液中不会进行双水解,但能促进水电离,氨水是弱电解质不完全电离,使铵根离子的浓度大于醋酸根离子浓度④氨水不完全电离,故离子浓度大小为②③①④;B、溶液中铵根离子水解产生氢离子,加入的NaOH溶液不仅要中和溶液中产生的H+也要对铵根离子水解产生的H+进行中和,即钠离子浓度最大,铵根离子进行水解生成氨水使铵根离子浓度小于硫酸根离子,又溶液最后显中性即氢离子浓度等于氢氧根离子浓度,故B正确;C、碳酸根离子水解程度较大,使溶液中碳酸氢根离子浓度大于碳酸根离子浓度,故C错误;D、反应为分解反应,在任何温度下都会自发进行,故D正确。
考点:离子浓度大小的比较

在密闭容器中存在如下反应:A (g)+3B(g) 2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断一定错误的是
| A.图Ⅰ研究的是压强对反应的影响,且乙的压强较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用催化剂的效率较高 |
某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
| A.K越大,达到平衡时,反应进行的程度越大 |
| B.K随着温度的升高而增大 |
| C.K越小,达到平衡时,反应物的转化率越大 |
| D.K随反应物浓度的改变而改变 |
纳米钴(Co)常用于CO加氢反应的催化剂,500 K时有催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
| A.纳米技术的应用,提高了催化剂的催化性能 |
| B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C.温度越低,越有利于CO催化加氢 |
| D.从平衡体系中分离出H2O(g)能加快正反应速率 |
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )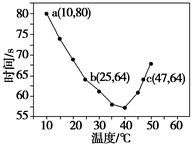
| A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1 |
| D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂 |
氢气既是最理想的能源又是重要的化工原料,用甲烷制氢气是一种廉价的制氢方法。有关的热化学方程式如下:
①CH4(g)+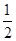 O2(g)
O2(g) CO(g)+2H2(g) ΔH<0
CO(g)+2H2(g) ΔH<0
②CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
下列说法不正确的是( )
| A.当反应①中v(CH4)正=v(CO)逆时,表明该反应达平衡状态 |
| B.其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小 |
| C.使用高效催化剂可以加快反应速率,同时提高CH4的转化率 |
| D.同一容器内同时发生反应①与②时,容器内温度可能保持不变 |
对于可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是 ( )。
4NO(g)+6H2O(g),下列叙述正确的是 ( )。
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5 |
| B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动 |
| C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 |
| D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡 |
 pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是( )。
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是( )。 CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法中正确的是( )
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法中正确的是( )