题目内容
(12分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+ —— Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,
e.稀硫酸,f.稀盐酸,g.蒸馏水。
[实验步骤]
①称取0.474 g KMnO4晶体,配成250.00 mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500 g),研细后加稀硫酸溶解,配成100.00 mL水溶液。
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中。
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数。
⑤滴定,并记录KMnO4标准溶液的终读数。再重复滴定2次。
[实验记录]
|
滴定次数 实验数据 |
1 |
2 |
3 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
|
V(KMnO4)/mL(初读数) |
0.00 |
0.20 |
0.00 |
|
V(KMnO4)/mL(终读数) |
15.85 |
15.22 |
14.98 |
[交流与讨论]
(1)准备的实验用品中,不需要的仪器有(填序号) ;不需要的试剂有(填序号) 。
(2)本实验所用的KMnO4标准溶液的物质的量浓度为 。
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是 (填字母序号)。

(4)判断滴定终点的依据是 。
(5)根据实验数据,计算该补血剂中铁元素的含量 。
(1)c,e,j c,d,f (2)1.200×10-2 mol·L-1
(3)b (4)滴入最后一滴KMnO4溶液恰好由无色变浅紫红色,且半分钟内不褪色
(5)16.8%
【解析】(1)根据实验过程可知,不需要的仪器是c,e,j。高锰酸钾溶液具有氧化性,且显紫红色,所以不需要的试剂是c,d,f,
(2)0.474 g KMnO4晶体的物质的量是0.474g÷158g/mol=0.003mol,所以其浓度为0.003mol÷0.25L=1.200×10-2 mol·L-1。
(3)酸性高锰酸钾溶液不能用碱式滴定管,ac不正确。所以答案选b。
(4)酸性高锰酸钾溶液显紫红色,所以当滴入最后一滴KMnO4溶液恰好由无色变浅紫红色,且半分钟内不褪色,即说明达到滴定终点。
(5)三次实验中消耗高锰酸钾溶液的体积分别是15.85ml、15.02ml、14.98ml,因此第一次实验数据不能用,后两次的平均值是15.00mol。因此消耗高锰酸钾的物质的量是0.015L×1.200×10-2 mol·L-1=0.00018mol,得到电子是0.00018mol×5=0.0009mol,所以根据电子的得失守恒可知,亚铁离子的物质的量0.0009mol,质量是0.0009mol×56g/mol=0.0504g,所以该补血剂中铁元素的含量是0.0504g×5÷1.5g×100%=16.8%。

 计算高手系列答案
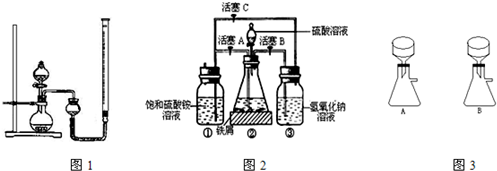
计算高手系列答案Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,______,然后研细;⑤检查④中洗涤是否完全的操作是______.
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.______.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]
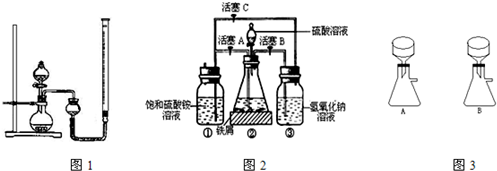
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞______,打开活塞______(填字母).向容器①中通人氢气的目的是______.
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是______.(填A或B)
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
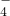 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O试求产品中摩尔盐的质量分数______.(NH4)2SO4?FeSO4?6H2O的相对分子质量为392.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤, ,然后研细;⑤检查④中洗涤是否完全的操作是 .
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B. .
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]
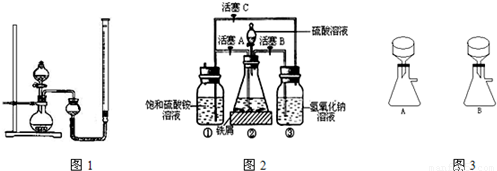
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母).向容器①中通入氢气的目的是 .
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是 .(填A或B)
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
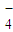 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O试求产品中摩尔盐的质量分数 .(NH4)2SO4?FeSO4?6H2O的相对分子质量为392.