题目内容
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,有红色金属析出且溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
(1) 3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O (2分)
(2) 16 g (2分)(没单位扣1分)
(3)0.1 mol (2分)(没单位扣1分)
(4) 0.05<n<0.15(2分)
【解析】
试题分析:(1)硝酸具有强氧化性,而氧化亚铜中铜的化合价是+1价,具有还原性,所以该反应的离子方程式是3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O。
(2)硝酸的物质的量是0.6mol,而被还原的硝酸是0.1mol,所以根据原子守恒可知,生成硝酸铜的物质的量是0.25mol,则铜原子的物质的量是0.25mol,质量是0.25mol×64g/mol=16g。
(3))设Cu2O的物质的量为m,CuO的物质的量为n,所以由得失电子守恒可得0.1mol×2+2m=0.1mol×3,解得m=0.05 mol,由铜原子守恒可得n=0.05 mol,则根据Cu2O+H2SO4=CuSO4+Cu+H2O和CuO+H2SO4=CuSO4+H2O可知,消耗稀硫酸的物质的量是0.1mol。
(4)由(2)知铜元素的总的物质的量为0.25 mol,设Cu2O、CuO的物质的量分别为x和y,则由得失电子守恒得2n+2x=0.1mol×3,解得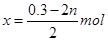 ;由铜守恒得n+2x+y=0.25mol,所以y=(n-0.05)mol。因Cu2O、CuO的物质的量均大于零,所以可得n的范围为0.05 mol<n<0.15 mol。
;由铜守恒得n+2x+y=0.25mol,所以y=(n-0.05)mol。因Cu2O、CuO的物质的量均大于零,所以可得n的范围为0.05 mol<n<0.15 mol。
考点:考查氧化还原反应的有关计算
点评:在进行化学计算时,需要准确把握反应中的有关化学反应原理,写出有关的化学方程式,然后再借助于各种守恒法,例如原子守恒、质量守恒、电荷守恒、电子得失守恒等。

 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物. [化学--物质结构与性质]
[化学--物质结构与性质]