题目内容
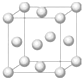 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.(1)基态Cu原子的电子排布式是
(2)①某+1价铜的配离子为[Cu(CN)4]3-,与配体互为等电子体的一种微粒是
②许多+1价铜的配合物溶液能吸收CO和烯烃(如C2H4、CH3CH=CH2等),CH3CH=CH2分子中c子采取的杂化方式有
(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液.写出此蓝色沉淀溶解的离子方程式:
分析:(1)铜是29号元素,原子核外有29个电子,根据构造原理书写其基态核外电子排布式;利用均摊法计算原子个数;
(2)①原子个数相同、价电子数相同的微粒是等电子体;
②根据价层电子对互斥理论确定杂化方式;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,根据价层电子对互斥理论确定其空间构型.
(2)①原子个数相同、价电子数相同的微粒是等电子体;
②根据价层电子对互斥理论确定杂化方式;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,根据价层电子对互斥理论确定其空间构型.
解答:解:(1)铜是29号元素,原子核外有29个电子,根据构造原理知其核外电子排布式为:1s22s22p63s22p63d104s1,该晶胞中铜原子个数=8×
+6×
=4,
故答案为:1s22s22p63s22p63d104s1;4;
(2)①某+1价铜的配离子为[Cu(CN)4]3-,其配体是CN-,与配体为等电子体的微粒有:CO、N2等,故答案为:CO、N2;
②CH3CH=CH2分子中甲基上的C原子含有4个共价单键,属于SP3杂化,碳碳双键两端上的碳原子含有3个 σ键,属于SP2杂化,故答案为:SP3、SP2;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,离子反应方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,SO42-中S原子价层电子对=4+
(6+2-4×2)=4,且不含孤电子对,所以是正四面体结构,
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;正四面体.
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:1s22s22p63s22p63d104s1;4;
(2)①某+1价铜的配离子为[Cu(CN)4]3-,其配体是CN-,与配体为等电子体的微粒有:CO、N2等,故答案为:CO、N2;
②CH3CH=CH2分子中甲基上的C原子含有4个共价单键,属于SP3杂化,碳碳双键两端上的碳原子含有3个 σ键,属于SP2杂化,故答案为:SP3、SP2;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,离子反应方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,SO42-中S原子价层电子对=4+
| 1 |
| 2 |
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;正四面体.
点评:本题考查物质结构,较综合,这些都是学习重点,会利用价层电子对互斥理论确定杂化方式、微粒空间构型,难度中等.

练习册系列答案
相关题目
 [化学--物质结构与性质]
[化学--物质结构与性质]