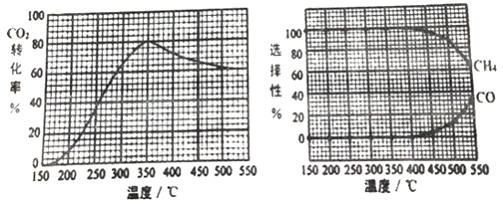
题目内容
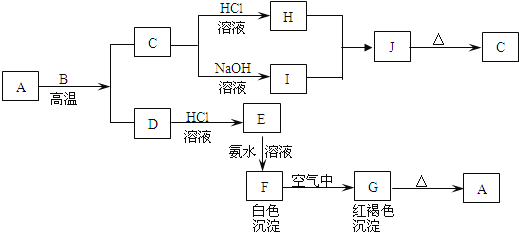
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
(1)写出下列物质的化学式:A:________,E:________,J:________,G:________.
(2)按要求写方程式:
①A与B在高温条件下生成C和D的化学方程式:________________________________;
②C转化为I的离子方程式:___________________________________________.
③F在空气中转化为G的化学方程式:__________________________________;
【答案】 Fe2O3 FeCl2 Al(OH)3 Fe(OH)3 Fe2O3+2Al![]() Al2O3+2Fe Al2O3+2OH-===2AlO+H2O 4Fe(OH)2+O2+2H2O===4Fe(OH)3
Al2O3+2Fe Al2O3+2OH-===2AlO+H2O 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【解析】A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠,
(1)根据上面的分析可以知道,则A为![]() ,E是氯化亚铁,J是氢氧化铝,G是氢氧化铁,
,E是氯化亚铁,J是氢氧化铝,G是氢氧化铁,
因此,本题正确答案是:![]() ;
;![]() ;
;![]() ;
;![]() ;
;
(2)![]() 与Al在高温条件下生成Fe和
与Al在高温条件下生成Fe和![]() ,化学方程式为
,化学方程式为![]()
氧化铝是两性氧化物,能和烧碱反应生成偏铝酸钠和水,离子反应方程式为![]() 因此,本题正确答案是:
因此,本题正确答案是: ![]()
;![]()
③由G是氢氧化铁,F是氢氧化亚铁,F在空气中转化为G的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3

 阅读快车系列答案
阅读快车系列答案【题目】磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
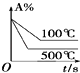
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。