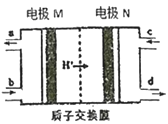
��Ŀ����
����Ŀ������˵�����ʾ����ȷ���ǣ� ��
A.�������������������ֱ���ȫȼ�գ����߷ų���������
B.ʹ�ô����ķ�Ӧ�����ȷ�Ӧ
C.��ϡ��Һ�У�H��+OH��=H2O ��H=��57.3 kJ��mol-1�������� 1 molCH3COOH �Ĵ�����Һ�뺬 1 mol NaOH ����Һ��ϣ��ų�������С�� 57.3 kJ
D.�� 101 kPa ʱ��2 g H2 ��ȫȼ������Һ̬ˮ���ų� 285.8 kJ ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ 2H2��g��+O2��g��=2H2O��l����H=+285.8 kJ��mol-1
���𰸡�C
��������
A����������ʱҪ���ȣ��������������������ֱ���ȫȼ�գ�ǰ�߷ų��������࣬��A����
B�������Ƿ�Ӧ���������ı䷴Ӧ�Ļ�ܣ���Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ������ޱ�Ȼ��ϵ����B����
C��CH3COOH��������ʣ�����ʱҪ���ȣ���ϡ��Һ�У�H��+OH��=H2O ��H=��57.3 kJ��mol-1�������� 1 molCH3COOH �Ĵ�����Һ�뺬 1 mol NaOH ����Һ��ϣ��ų�������С�� 57.3 kJ����C��ȷ��
D���� 101 kPa ʱ��2 g H2 ��ȫȼ������Һ̬ˮ���ų� 285.8 kJ ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ H2��g��+![]() O2��g��=H2O��l����H=-285.8 kJ��mol-1����D����
O2��g��=H2O��l����H=-285.8 kJ��mol-1����D����
��ѡC��

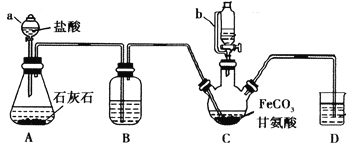
����Ŀ���ʰ�������[(NH2CH2COO)2Fe]��һ�ֲ���ǿ������ijѧϰС������FeCO3��ʰ���(NH2CH2COOH)�Ʊ��ʰ���������ʵ��װ������ͼ��ʾ(�гֺͼ���������ʡ��)��
�й������������±���
�ʰ��� | ������ | �ʰ������� |
������ˮ�������Ҵ� | ������ˮ���Ҵ� | ������ˮ���������Ҵ� |
���Ի����� | ǿ���ԡ�ǿ��ԭ�� |
ʵ����̣�
I���ϳɣ�װ��C��ʢ��0.1mol FeCO3��200mL1.0mol��L-1�ʰ�����Һ�����������ᡣʵ��ʱ���ȴ�����a�Ļ�������װ��c�п����ž����Ȳ����Ͻ��裬��ͨ������b��C�м�����������������Һ����p�ȵ�6���ң�ʹ��Ӧ���ַ�Ӧ��
�������룺��Ӧ�������ˣ�����Һ��������Ũ����������ˮ�Ҵ������ˡ�ϴ�Ӳ����
�ش��������⣺
��1������a��������________����a��ȣ�����b���ŵ���_____________________________��
��2��װ��B��ʢ�е��Լ���____________��ʵ�������װ��D�ĵ���һֱû��Һ���µı�Ҫ����___________________________________________��
��3���ϳɹ��̼���������������Ǵٽ�FeCO3�ܽ��________________________ ��
��4����������������Һ����pH������6���ʰ������������½���ԭ��������ӷ���ʽ��ʾΪ________��
��5������II�м�����ˮ�Ҵ���Ŀ����_______________________��
��6�������Ʒ���Ƿ���Fe3+���Լ�������_________ ��
��7����ʵ���Ƶ�15.3g�ʰ���������M=204g/mol�������������_____����